„Powikłania sercowo-naczyniowe leczenia celowanego w onkologii.”
Artykuł powstał w ramach projektu pt.: „Wydawnictwa dla Amazonek”, który realizowany jest dzięki dofinansowaniu ze środków Państwowego Funduszu Rehabilitacji Osób Niepełnosprawnych

Wstęp.
Rak piersi jest od wielu lat najczęściej rozpoznawanym nowotworem wśród kobiet w Polsce. W roku 2017 stwierdzono 18529 zachorowań na raka piersi i 6670 zgonów z tego powodu [1]. Od początku lat 80 obserwuje się gwałtowny wzrost zachorowalności na raka piersi we wszystkich grupach wiekowych. Co więcej coraz skuteczniejsze metody rozpoznawania i leczenia chorób nowotworowych powodują, że zwiększa się odsetek całkowitych wyleczeń i wydłuża się czas przeżycia u chorych. Szacuje się, że na przykład w roku 2018, liczba kobiet, które żyją na świecie z diagnozą raka piersi postawioną w ciągu ostatnich 5 lat wynosi 6.87 milionów [2]. Wiele z tych kobiet umrze z innych przyczyn niż rak piersi. Najczęściej będą to choroby sercowo-naczyniowe [1,2]. Uważa się, że stosowane współcześnie, skuteczne metody leczenia raka piersi, wpływając na zmniejszenie ryzyka zgonu z powodu tego nowotworu jednocześnie mogą powodować wzrost ryzyka występowania powikłań sercowo- naczyniowych. Podkreśla się, że powikłania sercowo naczyniowe u chorych na raka piersi wynikają głównie z zastosowania w leczeniu antracyklin, trastuzumabu (i innych leków celowanych oddziałujących na receptor HER2) oraz radioterapii uzupełniającej [3]. Największe prawdopodobieństwo wystąpienia powikłań sercowo-naczyniowych istnieje w grupie pacjentów z czynnikami ryzyka, takimi jak nadciśnienie tętnicze oraz wiek powyżej 70 lat. Trzeba także podkreślić, że zaznacza się wyraźnie wzrost ryzyka powikłań sercowo naczyniowych w grupie pacjentów, u których zastosowano w leczeniu klika potencjalnie kardiotoksycznych metod terapii (np. antracykliny i trastuzumab) [3,4].
W ostatnich latach odnotowuje się wyraźny wzrost zainteresowania tematem powikłań sercowo-naczyniowych mogących pojawić się podczas leczenia raka piersi, szczególnie leczonego radykalnie. Opublikowano wiele prac poświęconych metodom zapobiegania tym powikłaniom, zarówno poprzez bardziej staranną kwalifikację chorych do potencjalnie kardiotoksycznych metod terapii, jak również unikanie skojarzeń terapii o podobnym mechanizmie negatywnego oddziaływania na układ sercowo-naczyniowy oraz opracowaniu stosownych interwencji pozwalających uniknąć powikłań sercowo-naczyniowych [3,4].
Poniżej omówiono pokrótce najważniejsze zagadnienia z zakresu powikłań sercowo-naczyniowych związanych z leczeniem lekami celowanymi anty HER2. Leki z tej grupy znajdują zastosowanie w terapii chorych na raka piersi, u których stwierdzono zwiększoną ekspresję receptora HER2 (około 20% wszystkich chorych na raka piersi). Jest to grupa pacjentów o złym rokowaniu, która jednakże może być skutecznie leczona przy pomocy leków oddziałujących na receptor HER2 [4]. Najczęściej stosuje się trastuzumab, pertuzumab, koniugat trastuzumab emtazyna, lapatynib, neratynib. Leki z tej grupy z zasady kojarzy się z cytostatykami lub lekami hormonalnymi (antyestrogeny, inhibitory aromatazy), co często może dodatkowo zwiększać ryzyko wystąpienia uszkodzeń układu sercowo-naczyniowego [3,5].
Mechanizm kardiotoksyczności terapii antyHer2.
Receptor HER2 jest ważnym mediatorem wzrostu i różnicowania komórek. Bierze udział w embriogenezie serca [6]. W okresie płodowym i noworodkowym rozwoju mięśnia serca występuje ekspresja receptorów HER2, HER3 i HER4. U dorosłych, komórki mięśnia serca wykazują nadal ekspresję receptora HER2 i HER4 (ale nie HER3) [7, 8, 9]. Działanie trastuzumabu na mięsień sercowy poprzez receptor HER2 wynika głównie z aktywacji jądrowego czynnika transkrypcji k (NF-k). Aktywacja szlaków Akt i NF-k odbywa się również w przypadku oddziaływania sytuacji stresowych na miocyty [9]. Podczas stresu komórkowego, takiego jak niedotlenienie i stres oksydacyjny, białko zwane neureguliną jest uwalniane przez komórki śródbłonka znajdujące się w naczyniach wieńcowych i wsierdziu. Istnieją cztery rodzaje neuregulin: białka neureguliny 1 (NRG-1) należą do rodziny czynników wzrostu naskórka i wiążą się bezpośrednio z receptorami HER3 i HER4, jednocześnie wiążąc jednostkę HER2 jako koreceptor. Powoduje to dimeryzację receptorów HER2 i aktywację szlaków przeżycia komórek, które z kolei hamują apoptozę komórkową. Dochodzi też do stymulacji produkcji śródbłonkowych tlenków azotu (eNOS) [10, 11,12].
Neuregulina 1 chroni serce poprzez kilka mechanizmów, które obejmują utrzymanie struktury miofibryli, promowanie przeżycia kardiomiocytów, ich wzrost i proliferację, równoważenie efektów adrenergicznych i utrzymanie homeostazy wapniowej, poprawę angiogenezy i stymulowanie różnicowania komórek macierzystych w kardiomiocyty [13,14,15]. Zatem w kardiomiocytach receptory HER2 mają kluczowe znaczenie dla neureguliny 1 i promowania jej ochronnego działania na serce.
Prawidłowe funkcjonowanie receptorów HER2 jest też ważne dla funkcji i struktury skurczu mięśnia sercowego. W eksperymentach na szczurzych kardiomiocytach przeciwciało anty-HER2 lub inhibitor HER1 / HER2 indukuje nieład i utratę miofibryli. Ponadto leki hamujące receptor HER2 i niektóre cytostatyki (doksorubicyna i paklitaksel) mają dodatkowo wpływ na uszkodzenie struktury miofibryli [7,11].
Wyniki badań ekspresji genów serca myszy otrzymujących trastuzumab sugerują, że trastuzumab może uszkadzać kardiomiocyty przez upośledzenie funkcji skurczowej kardiomyocytów, a także naprawę DNA [16].
U pacjentów leczonych antracyklinami i lekami celowanymi antyHER2 można zaobserwować dwa odrębne mechanizmy kardiotoksyczności: typ I i typ II.
Kardiotoksyczność typu I, związana z antracyklinami, jest zależna od dawki, nieodwracalna i związana ze zmianami strukturalnymi mięśnia serca. Kardiotoksyczność typu II, wynikająca z działania trastuzumabu nie jest zależna od dawki, jest w dużej mierze odwracalna, ale może również powodować zmiany strukturalne w badaniu histologicznym kardiomiocytu [17]. Mechanizm powstania obu tych toksyczności jest odmienny i dlatego w przypadku skojarzenia antracyklin i leków celowanych anyHER2 dochodzi do kumulacji działań niepożądanych w układzie sercowo-naczyniowym [5].
Mechanizm kardiotoksyczności leków działających na receptor HER2 przedstawiono na ryc.1.
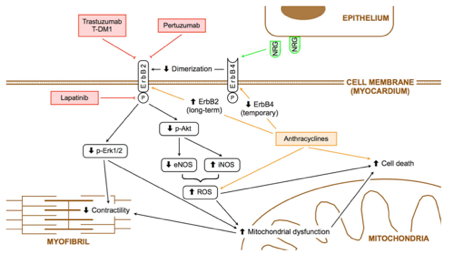
Rycina 1. Mechanizm kardiotoksyczności leków działających na receptor HER2.
Powikłania sercowo- naczyniowe wynikające z leczenia trastuzumabem.
Trastuzumab to rekombinowane, humanizowane przeciwciało monoklonalne IgG1, uzyskiwane z kultur tkankowych komórek jajnika chomika chińskiego metodami inżynierii genetycznej. Łączy się ono wybiórczo z receptorem ludzkiego naskórkowego czynnika wzrostu 2 (ang. human epidermal growth factor receptor 2 – HER2), hamując proliferację komórek, które wykazują zwiększoną ekspresję receptora HER2. Ponadto trastuzumab jest silnym mediatorem cytotoksyczności komórkowej zależnej od przeciwciał (antibody-dependent cellular cytotoxicity – ADCC). Pobudza cytotoksyczność typu ADCC wobec komórek nowotworu wykazujących zwiększoną ekspresję receptora HER2 [18].
Wprowadzenie trastuzumabu do praktyki klinicznej w 1998 roku (rejestracja Food and Drug Administration) zmieniło naturalną historię HER2 -dodatniego raka piersi, powodując, że wybitnie do tej pory złe wyniki leczenia zaczęły być porównywalne z wynikami leczenia chorych na raki hormonozależne. W 2005 roku potwierdzono skuteczność trastuzumabu w leczeniu uzupełniającym wczesnego raka piersi. Okazało się, że wprowadzenie trastuzumabu w tym wskazaniu zmniejsza względne ryzyko zgonu o około 33% [19].
Wstępne badania II fazy z trastuzumabem obejmujące chorych na uogólnionego raka piersi nie wykazały znaczącej kardiotoksyczności [20,21]. Jednak kluczowe badanie nad HER2-dodatnim rakiem piersi z przerzutami, prowadzone przez Slamona i wsp. [18], wykazało wyższy niż oczekiwano wskaźnik kardiotoksyczności w przypadku jednoczesnego stosowania antracyklin z trastuzumabem (27%) i paklitakselu z trastuzumabem (13%). Pacjenci otrzymujący antracykliny w tym badaniu otrzymali łączną dawkę doksorubicyny przekraczającą 300 mg / m2, co jest uznanym czynnikiem zwiększonego ryzyka kardiotoksyczności [18, 22]. Co ważniejsze, ocena serca nie została zdefiniowana prospektywnie w tym badaniu, dlatego niezależna ocena kardiologiczna mogła opierać się jedynie na analizie retrospektywnej. Wysoki wskaźnik kardiotoksyczności podczas jednoczesnego podawania trastuzumabu i antracyklin zgłaszany w tym badaniu nie był jednak obserwowany również w innych pracach [3].
W badaniu klinicznym NOAH trastuzumab podawano jednocześnie z antracykliną w leczeniu neoadiuwantowym. Stosowano tam trzy cykle chemioterapii z antracyklinami (dawka skumulowana doksorubicyny 180 mg / m2). Zgłaszany wskaźnik objawowych zdarzeń sercowych był bardzo niski (2%), co potwierdza hipotezę, że podstawowe znaczenie ma skumulowana dawka antracyklin [23]. W kolejnym badaniu prowadzonym przez grupę naukowców z MD Anderson stosowano jednocześnie trastuzumab i chemioterapię opartą na antracyklinach w operacyjnym HER2 dodatnim raku piersi i nie wykazano zwiększonego odsetka kardiotoksyczności [24].
Retrospektywna analiza powikłań kardiologicznych siedmiu badań fazy II i III nad trastuzumabem [23] opublikowana w 2002 roku obejmowała cztery podstawowe kryteria określające dysfunkcję serca: (1) kardiomiopatia ze zmniejszoną frakcją wyrzutową lewej komory (LVEF) globalnie lub głównie zaznaczoną w obrębie przegrody międzykomorowej, (2) objawy niewydolności serca, zwłaszcza duszność, ortopnoe i obrzęki, (3) objawy niewydolności serca przebiegające z zaburzeniami rytmu, (4) bezobjawowy spadek LVEF o 10%, ale do mniej niż 55% lub spadek LVEF o 5%, ale do mniej niż 55%, z objawami podmiotowymi lub przedmiotowymi niewydolności serca. Zidentyfikowano 112 pacjentów spełniających powyższe kryteria dysfunkcji serca. Większość (n = 83) pacjentów miała co najmniej jeden objaw niewydolności serca i wszyscy, z wyjątkiem jednego, otrzymywali leczenie niewydolności serca, które obejmowało leki moczopędne, inhibitory ACE, beta-adrenolityki, glikozydy nasercowe i środki inotropowe. Potwierdzono, że 79% pacjentów osiągnęło kontrolę objawów podczas leczenia. Na podstawie tych danych zrezygnowano ostatecznie rekomendacji jednoczesnego stosowania trastuzumabu i chemioterapii opartej na antracyklinach u chorych na przerzutowego raka piersi. Jednocześnie jednak opracowano kolejne badania randomizowane dotyczące wczesnego raka piersi w celu oceny toksyczności jednoczesnego podawania antracyklin i trastuzumabu w sposób sekwencyjny i przy ścisłym monitorowaniu bezpieczeństwa serca [22].
Badania prowadzone w leczeniu uzupełniającym wczesnego raka piersi , takie jak National Surgical Adjuvant Breast and Bowel project (NSABP) B-31, North Central Cancer Tretment Group (NCCTG) N 9831, Herceptin Adjuvant (HERA), Breast Cancer International Research Group (BCIRG) 006, Finlandia Herceptin (Fin Her) i Programm Adjuvant Cancer Sein (PACS) 04 analizowały zastosowanie trastuzumabu po zakończeniu leczenia antracyklinami lub w ogóle po zakończeniu chemioterapii [ 19, 25 – 30]. Badania te wykazały, że częstość zgonów z przyczyn sercowych i ciężkiej zastoinowej niewydolności serca nie różniła się istotnie między pacjentami leczonymi trastuzumabem a tymi, którzy nie otrzymywali tego leku ( różnica <4%). Jednak duża liczba pacjentów przerywała leczenia trastuzumabem z powodu bezobjawowego pogorszenia czynności serca, co oceniano za pomocą echokardiografii lub MUGA [26,27]. Co ciekawe, pomimo , że w badaniu FinHer trastuzumab podawano przez 9 tygodni w połączeniu z taksanem przed chemioterapia z antracyklinami (FEC), nie stwierdzono żadnych powikłań kardiologicznych w grupie chorych otrzymujących trastuzumab, a następnie antracykliny. Wytłumaczeniem tej obserwacji może być hipoteza, że zastosowanie trastuzumabu przed antracyklinami mogło pozwolić kardiomiocytom na regenerację przed chemioterapią [30,31].
We wszystkich badaniach oceniających trastuzumab w leczeniu uzupełniającym skrupulatnie oceniano czynność serca w sposób prospektywny i włączono do nich jedynie pacjentów z prawidłową czynnością serca. Kryteria włączenia zwykle wymagały aby frakcja wyrzutowa lewej komory (LVEF) wynosiła ≥50% lub ≥55% i aby u pacjentów nie występowały wcześniej choroby serca, takie jak niewydolność serca, choroba niedokrwienna lub zastawkowa serca, arytmia (z wyjątkiem kontrolowanej arytmii przedsionkowej) lub źle kontrolowane nadciśnienie [28, 29, 32]. Wiek powyżej 80 lat i choroba wieńcowa również były w niektórych badaniach identyfikowane jako dodatkowe czynniki ryzyka [ 33, 34].
Wprowadzenie dość restrykcyjnych kryteriów włączania pacjentów do badan klinicznych może prowadzić do różnic w obserwowanych odsetkach powikłań kardiotoksycznych trastuzumabu w opublikowanych badaniach klinicznych a codzienną praktyką kliniczną [35]. Obecnie trwają badania nad identyfikacją biomarkerów, które można zastosować do wczesnego wykrywania kardiotoksyczności wywołanej przez trastuzumab, między innymi troponiną I (TnI) i peptydem natriuretycznym (proBNP) [26, 34].
Podsumowując trzeba podkreślić, że stosowanie trastuzumabu po antracyklinach [19, 25, 28, 29], lub w schematach leczenia w ogóle nie zawierających antracyklin [19] radykalnie zmniejszyło ryzyko objawów uszkodzenia serca. Zjawisko to tłumaczone jest faktem, czasowego, odwracalnego zmniejszenia w kardiomiocytach ekspresji receptora HER2 w wyniku stosowania antracyklin [36]. Z drugiej strony wykazano, że długotrwała ekspozycja na antracykliny może powodować zwiększoną ekspresję receptora HER2 na kardiomiocytach [36,37].
Z cała pewnością nie wykazano różnic w kardiotoksyczności pomiędzy różnymi schematami podawania trastuzumabu (co tydzień lub co 3 tygodnie) ani też, pomiędzy formą dożylna a podskórną tego leku [25, 38 – 40].
W wielu publikacjach podkreśla się fakt, że kardiotoksyczność trastuzumabu nie jest związana z jego dawka kumulacyjną [ 39 ]. Jednak wykazano bezsprzecznie, że wystąpienie powikłań kardiotoksycznych jest związane z długością ekspozycji na trastuzumab, im dłuższy czas ekspozycji, tym większe ryzyko wystąpienia powikłań kardiotoksycznych [30, 39, 40]
Powikłania sercowo-naczyniowe wynikające z leczenia pertuzumabem.
Problem kardiotoksyczności indukowanej pertuzumabem oceniano w kilku badaniach fazy I. Kryterium wykluczającym udział pacjentów w tych badaniach była niska wyjściowa frakcją wyrzutowa lewej komory ( <50%). U jednego pacjenta doszło do wystąpienia zawału mięśnia sercowego, u trzech stwierdzono bezobjawowy spadek frakcji wyrzutowej lewej komory (od 5% do 14%). Bezobjawowy wzrost poziomów BNP odnotowano u 50% pacjentów, bez spadku LVEF [41,42]. W neoadjuwantowym badaniu klinicznym NeoSphere nie zaobserwowano znaczącego wzrostu przypadków wystąpienia dysfunkcji lewej komory wraz z dodaniem pertuzumabu do trastuzumabu [43,44] .
W przypadku uogólnionego raka piersi w badaniu klinicznym CLEOPATRA liczba zdarzeń niepożądanych związanych z uszkodzeniem mięśnia sercowego była nieco niższa w grupie stosującej pertuzumab i trastuzumab i wynosiła 14,5% w porównaniu z 16,4% w grupie kontrolnej placebo i trastuzumab. Również liczba objawów kardiotoksycznych w stopniu 3 i 4 (głównie dysfunkcji lewej komory) była mniejsza w ramieniu badanym (z pertuzumabem) w porównaniu z ramieniem z placebo (odpowiednio 1,5 vs 3,8%) [45, 46].
Ciekawe są też wyniki pracy opublikowanej przez Lenihana i współpracowników, gdzie przedstawiono wyniki analizy przeprowadzonej na dużej bazie danych, 598 pacjentów leczonych pertuzumabem w celu oceny częstości występowania bezobjawowej dysfunkcji LVEF i objawów niewydolności serca. 331 pacjentów otrzymało tylko pertuzumab, 93 pacjentów otrzymało leczenie podwójną blokadą (pertuzumabem i trastuzumabem) , a pozostałe 175 otrzymywała pertuzumab w skojarzeniu z cytostatykiem innym niż antacykliny. U 6,9% chorych leczonych tylko pertuzumabem wystąpił bezobjawowy spadek frakcji wyrzutowej lewej, tylko u 1 pacjenta (0,3%) wystąpiła objawowa niewydolność serca. W grupie leczonej podwójna blokadą antyHER2 u 6 pacjentów (6,5%) wystąpiła bezobjawowa dysfunkcja LVEF, a u 1 pacjenta (1,1%) wystąpiła objawowa niewydolność serca. Wreszcie w grupie leczonej pertuzumabem i chemioterapią bez u 6 pacjentów (3,4%) rozwinęła się bezobjawowa dysfunkcja LVEF, a u 2 pacjentów (1,1%) wystąpiła objawowa niewydolność serca [47].
Wydaje się więc, że dodanie pertuzumabu do terapii zawierającej trastuzuamab nie zwiększa zupełnie ryzyka wystąpienia powikłań kardiotoksycznych, co próbuje się tłumaczyć brakiem wpływu pertuzumabu na dimeryzację receptorów HER kardiomiocytów [48].
Powikłania sercowo-naczyniowe wynikające z leczenia TDM-1.
Ryzyko wystąpienie kardiotoksyczności w trakcie leczenia koniugatem trastuzumabu i emtasyny (TDM-1) jest niewielkie, tym niemniej takie ryzyko istniej, ze względu na obecność trastuzumabu w cząsteczce. W badaniu EMILIA, w którym T-DM1 porównywano z lapatinibem i kapecytabiną u pacjentów z uogólnionym HER2 dodatnim rakiem piersi, dane dotyczące bezpieczeństwa zastosowania TDM1 były bardzo zachęcające: tylko u 8 (1,7%) pacjentów frakcja wyrzutowa spadła poniżej 50% i co najmniej o 15 punktów procentowych poniżej wartości wyjściowej [49].
Również badanie III fazy TH3RESA potwierdziło niski odsetek zdarzeń niepożądanych sercowo-naczyniowych podczas leczenie chorych na uogólnionego raka piersi koniugatem trastuzumabu i emtazyny [50].
W badaniu MARIANNE spadek frakcji lewej komory zaobserwowano jedynie u 0,8% leczonych. Należy przy tym wspomnieć, że toksyczność kardiologiczna w tym badaniu wystąpiła za to u 4,5% pacjentek leczonych w ramieniu kontrolnym trastuzumabem w skojarzeniu z chemioterapią [51].
Niski odsetek toksyczności kardiologicznej obserwowano także w badaniach podsumowujących stosowanie T-DM1 w rutynowej praktyce klinicznej [52]. Podkreślić należy także, że w większości badań klinicznych z zastosowaniem trastuzumabu emtanzyny wyjściowa wartość LVEF pacjentów wynosiła ≥50%, a z udziału w nich wykluczono chorych z zastoinową niewydolnością serca, ciężkimi, wymagającymi leczenia zaburzeniami rytmu serca, zawałem mięśnia sercowego w wywiadzie, niestabilną chorobą wieńcową w ciągu 6 miesięcy przed randomizacją lub z dusznością spoczynkową spowodowaną zaawansowaną chorobą nowotworową.
W badaniu klinicznym III fazy KATHERINA, oceniającym leczenie uzupełniające chorych, których nie osiągnięto całkowitej remisji patologicznej po terapii neoadjuwantowej, co prawda częściej obserwowano zdarzenia niepożądane w ramieniu z TDM-1 (98.8% vs 93.3%), ale toksyczności sercowo- naczyniowe w tej grupie były rzadkie: u 2.0% chorych zaobserwowano nadciśnienie tętnicze w stopniu 3 lub 4, a u 1.2% spadła wartość frakcji wyrzutowej lewek komory. Poważne objawy kardiotoksyczne opisano u 4 pacjentów w grupie trastuzumabu (0,6%) i 1 pacjenta w grupie T-DM1 (0,1%) [53].
Mimo tak niskiego ryzyka wystąpienia kardiotoksyczności zaleca się mimo wszystko ocenę LVEF przed rozpoczęciem leczenia T-DM1 oraz okresową jego kontrolę w trakcie prowadzenia leczenia [54].
Powikłania sercowo-naczyniowe lapatynibu z kapecytabiną.
Lapatynib jest inhibitorem podwójnej wewnątrzkomórkowej kinazy tyrozynowej receptora czynnika wzrostu naskórka (EGFR, ErbB-1) oraz receptora HER2/neu (ErbB-2) komórek nowotworowych.
W kluczowym badaniu III fazy oceniającym połączenie lapatynibu z kapecytabiną opublikowanym w 2006 r. pacjenci leczeni wcześniej antracyklinami, taksanami i trastuzumabem, a którzy nadal mieli prawidłową LVEF zostali losowo przydzieleni do grupy otrzymującej kapecytabinę w monoterapii lub w skojarzeniu z lapatynibem. Zdarzenia sercowe zdefiniowano jako objawową niewydolność serca lub zmniejszenie LVEF o 20% lub więcej. Częściej zdarzenia niepożądane sercowo-naczyniowe obserwowano w grupie otrzymującej lapatynib (2,45% vs 0,62%). Jednak w obu grupach ryzyko spadku LVEF lub wystąpienia objawowej niewydolności krążenia było stosunkowo niskie [55].
Późniejsze publikacje wydają się potwierdzać mniejsze ryzyko zaburzeń czynności lewej komory po zastosowaniu lapatynibu w porównaniu z trastuzumabem zarówno w monoterapii, jak i hormonoterapią (inhibitor aromatazy) [56,57].
W opublikowanej w 2017 metaanalizie oceniono 26 badań klinicznych (prawie 5500 pacjentów) pod kątem sercowo-naczyniowych zdarzeń niepożądanych indukowanych laptynibem. Stwierdzono, że wszystkie zdarzenia sercowo-naczyniowe (zaburzenia rytmu serca, spadek LVEF i inne) dotyczyły tylko 3.00% leczonych, a częstość występowania dysfunkcji lewej komory i spadek LVEF wystąpił tylko u 1.70% chorych [58].
Powikłania sercowo-naczyniowe neratynibu.
Neratynib to doustny, nieodwracalny inhibitor kinaz tyrozynowych, inhibitor receptorów HER1, HER2 oraz HER4. Lek ten wykazuje aktywność w leczeniu HER2 dodatnich nowotworów, w tym głownie raka piersi. Podczas badań nad tym lekiem nie obserwowano kardiotoksyczności stopnia 3 lub 4 u pacjentów w badaniu fazy 2. Odnotowano jedynie nieznaczne spadki frakcji wyrzutowej lewej komory w porównaniu z wartościami początkowymi u pacjentów niezależnie od wcześniejszego leczenia trastuzumabem [59] . Kardiotoksyczność w badaniach fazy 3 (ExteNET i NEfERT-T) była minimalna [60, 61]. Nie zaobserwowano też dowodów na zwiększoną późną toksyczność, szczególnie u pacjentów otrzymujących neratynib w leczeniu uzupełniającym [62]. Neratynib został zatwierdzony do stosowania w leczeniu uzupełniającym po terapii opartej na trastuzumabie i obecnie charakterystyka produktu tego leku nie zawiera ostrzeżenia o kardiotoksyczności [63].
Czynniki ryzyka wystąpienia powikłań sercowo-naczyniowych
Podstawową strategią zapobiegania wystąpienia powikłań sercowo-naczyniowych jest ocena pacjenta przed kwalifikacją do leczenia terapiami antyHER2.
Do najczęściej wymienianych czynników ryzyka wystąpienia objawów kardiotoksycznych należą: choroby mięśnia sercowego, niewydolność serca, bezobjawowa dysfunkcja lewej komory (LVEF <50%), choroba niedokrwienna serca, nadciśnienie tętnicze z przerostem lewej komory, kardiomiopatie, sarkoidoza z zajęciem mięśnia sercowego, znaczące zaburzenia rytmu serca, wcześniejsze leczenie antracyklinami lub innymi lekami kardiotoksycznymi, wcześniejsza radioterapia klatki piersiowej lub śródpiersia, wiek (populacja pediatryczna <18 lat; i > 50 lat dla trastuzumabu), cukrzyca, hipercholesterolemia, palenie papierosów, spożywanie alkoholu, otyłość, siedzący tryb życia [64].
Pacjenci ze stwierdzonym jednym lub więcej wymienionych czynników ryzyka, powinni być włączani do leczenia lekami z grupy terapii antyHEr2 z dużą ostrożnością. Powinni też pozostawać pod opieką kardiologa oraz częściej podlegać badaniom monitorującym bezpieczeństwo leczenia.
Odrębności terapii celowanej anty-HER2 w leczeniu raka piersi w wieku podeszłym.
Pacjenci powyżej 65 roku życia chorujący na raka piersi stanowią bardzo różnorodną grupę, zarówno pod względem stanu biologicznego, jak i współwystępujących chorób. Ma to oczywiście zasadniczy wpływ na kwalifikowanie chorych do terapii przeciwnowotworowych.
Zwykle uznaje się, iż podejmowanie decyzji o zakresie diagnostyki lub leczenia wyłącznie na podstawie wieku biologicznego jest błędem i może doprowadzić do zaniechania właściwego postępowania u osób, które potencjalnie by się do niego kwalifikowały. Niestety wciąż stosunkowo niewiele jest dostępnych zaleceń dotyczących leczenia osób w wieku podeszłym. Wynika to w dużej mierze z tego, iż przez wiele lat pacjenci z tej grupy wiekowej nie byli włączani do badań klinicznych. Dla przykładu- tylko 16% pacjentów w badaniach z zastosowaniem uzupełniającego leczenia trastuzumabem miało powyżej 60 lat [65, 66]. Zalecenia dotyczące zasad postępowania z pacjentami w podeszłym wieku zazwyczaj opierają się więc na analizach retrospektywnych, analizach podgrup lub ekstrapolacji wyników badań pacjentów młodszych. Niestety takie postępowanie wiąże się z dużym ryzykiem popełnienia błędu, a to z kolei ma wpływ na zarówno na bezpieczeństwo leczenia jak i na rokowania [67].
Na szczęście od kilku lat obserwuje się coraz większe zainteresowanie leczeniem raka piersi u pacjentów w wieku podeszłym oraz większy udział tej grupy chorych w badaniach klinicznych, co jest głównie zasługą działań Międzynarodowego Towarzystwa Onkologii Geriatrycznej (International Society of Geriatric Oncology, SIOG), które publikuje również zalecenia postępowania dla tych chorych [68, 69]. Obecnie zaleca się żeby pacjentów w podeszłym wieku oceniać według zasad całościowej oceny geriatrycznej a także analizować choróby współistniejące i stosowane leki. Wiadomo bowiem, iż występowanie poważnych chorób towarzyszących oraz konieczność pomocy w aktywnościach życia codziennego (activities of daily living, ADLs) lub podstawowych aktywnościach życia codziennego (instrumental activities of daily living, IADLs) zwiększa ryzyko wczesnego zgonu z przyczyn innych, niż sam rak piersi [70].
U pacjentów z HER2-dodatnim rakiem piersi oczywiście zawsze powinno się rozważać zastosowanie leczenia anty-HER2. Należy jednak szczególnie uważnie dokonać wyboru schematu leczenia mając na uwadze zwłaszcza ryzyko powikłań sercowo-naczyniowych. Preferowanymi schematami są te oparte na taksanach. W celu zminimalizowania ryzyka wystąpienia powikłań warto rozważyć zastosowanie jako chemioterapii towarzyszącej trastuzumabowi 12 kursów paklitakselu, zwłaszcza u pacjentów z niskim ryzykiem nawrotu [71].
Dyskusyjne jest leczenie samym trastuzumabem, u tych pacjentów, u których wynik oceny geriatrycznej wyklucza zastosowanie chemioterapii. Dysponujemy obecnie jednak wynikami japońskiego badania III fazy RESPECT, w którym udowodniono, iż u pacjentek w wieku 70-80 lat za-stosowanie samego trastuzumabu może przynieść korzyść kliniczną [72]. U tych pacjentek, które nie kwalifikują się do leczenia chemioterapią, a u których występuje ekspresja receptorów hormonalnych można rozważyć zastosowanie leczenia anty-HER2 w skojarzeniu z hormonoterapią.
Możliwości prewencji powikłań sercowo-naczyniowych w leczeniu raka piersi.
W ostatnich latach coraz więcej publikacji poświęconych jest metodom umożliwiającym zapobieganie wystąpienia powikłań sercowo-naczyniowych u chorych leczonych onkologicznie. Jest to szczególnie istotne z uwagi na fakt, że metody leczenia wielu nowotworów, w tym szczególnie raka piersi pozwalają na całkowite wyleczenie coraz większej liczby pacjentów. Niestety część z tych pacjentów może zginąć w wyniku powikłań sercowo-naczyniowych wynikających z wcześniej potencjalnie kardiotoksycznej terapii. Według danych niemieckich w ostatnim czasie istotnie wzrosła (do ponad 20%) liczba chorych, leczonych wcześniej z powodu rak piersi, która wymagała hospitalizacji z przyczyn kardiologicznych [2].
Wytyczne dotyczące monitorowania i zarządzania kardiotoksycznością wywołaną leczeniem są opracowane przez Europejskie Towarzystwo Onkologii Medycznej (ESMO), National Comprehensive Cancer Network (NCCN), American Society of Clinical Oncology (ASCO) oraz European Society of Cardiology ( ESC) [ 54, 73 -75].
Podczas tworzenia planu leczenia należy dokładnie rozważyć indywidualne czynniki ryzyka dla każdego pacjenta, aby wybrać zarówno odpowiednią terapię, jak i niezbędny plan monitorowania wydolności serca. Chociaż zalecane jest ciągłe monitorowanie pacjentów leczonych trastuzumabem, wszystkie wytyczne wskazują, że nie określono optymalnego odstępu czasu pomiędzy kolejnymi ocenami. Pacjenci ze zwiększonym ryzykiem wystąpienia zdarzeń sercowych są często wykluczani z badań, co powoduje, że jest niewiele danych na temat leczenia pacjentów z jakąkolwiek chorobą serca. Stanowi to niestety problem w codziennej praktyce klinicznej. Podkreśla to potrzebę badań, takich jak trwające badanie SAFE-HEaRT u pacjentów z niewielkim spadkiem LVEF [76].
Ocenia się różne możliwości oceny uszkodzenia mięśnia serca podczas terapii antyHER2. Dokonał się istotny postęp w technikach badań obrazowych serca (ECHO, MR, MUGA). Duże nadzieje wiąże się także z biomarkerami uszkodzenia mięśnia serca. Jednym z nich jest troponina. Rozwój technik laboratoryjnych pozwalających na wykrywanie niewielkich ilości troponiny wydaje się obiecujący. Szczególnie skuteczne wydaje się także skojarzenie badań obrazowania mięśnia sera z poziomem troponiny [77,78].
Prowadzone są także prace oceniające skuteczność wdrożenia leczenia farmakologicznego jako prewencji pierwotnej wystąpienia powikłań kardiotoksycznych. Ocenienie są preparaty z grupy beta blokerów (carvedilol), inhibitory enzymu konwertującego angiotensynę i blokery receptora angiotensyny (telmisartan, candesartan, perindopril) [64].
Nie sposób także nie wspomnieć, że publikowane są także prace podkreślające rolę otyłości i nadwagi jako elementów znacznego ryzyka wystąpienia kardiotoksyczności w trakcie leczenia antyHER2 oraz roli wdrażania technik walki z otyłością jako pierwotnej prewencji tych powikłań [79].
Podsumowanie.
Dzięki wieloletniemu doświadczeniu w badaniach klinicznych i publikacjom opartym na codziennej praktyce, opracowano wytyczne dotyczące optymalnego zarządzania kardiotoksycznością pojawiającą się podczas terapii ukierunkowanych antyHER2. Rutynowe monitorowanie czynności serca, modyfikacja dawek lub zaprzestanie terapii przeciwnowotworowych oraz leczenie farmakologiczne wczesnej kardiotoksyczności przyczyniają się do poprawy wyników leczenia chorych na HER2 dodatniego raka piersi. Jednak w przypadku pacjentów z istniejącymi wcześniej chorobami serca lub u których rozwija się kardiotoksyczność w trakcie terapii, nadal nie mamy wystarczających możliwości skutecznego leczenia. Szereg trwających badań z pewnością dostarczy dodatkowych informacji na temat ulepszonych technik monitorowania, interwencji i strategii optymalnego leczenia pacjentów z chorobą serca w wywiadzie oraz z objawami uszkodzenia mięśnia sercowego w trakcie terapii [80].
Piśmiennictwo:
1. Didkowska J, Wojciechowska U, Czaderny K, Olasek P, Ciuba A. Nowotwory złośliwe w Polsce w 2017 roku. ISSN 0867-8251, Warszawa 2019, http://onkologia.org.pl/
2. Buddeke J, Gernaat SAM, Bots ML et al. Trends in the risk of cardiovascular disease in women with breast cancer in a Dutch nationwide cohort study. BMJ Open 2019;9:e022664. doi:10.1136/bmjopen-2018-022664
3. Dias A, Claudino W, Sinha R, Perez CA, Jain D. Human epidermal growth factor antagonists and cardiotoxicity—A short review of the problem and preventative measures. Critical Reviews in Oncology/Hematology 104 (2016) 42–51
4. Yu AF, Singh JC,Wang R et al. Cardiac Safety of Dual Anti-HER2 Therapy in the Neoadjuvant
Setting for Treatment of HER2-Positive Breast Cancer. The Oncologist 2017;22:642–647 www.TheOncologist.com
5. Leemasawat K,Phrommintikul A, Chattipakorn SC, Chattipakorn N Mechanisms and potential interventions associated with the cardiotoxicity of ErbB2‑targeted drugs: Insights from in vitro, in vivo, and clinical studies in breast cancer patients. Cellular and Molecular Life Sciences https://doi.org/10.1007/s00018-019-03340-w
6. Erickson, S.L., O’Shea, K.O., Ghaboosi, N., et al., 1997. ErbB3 is required for normal cerebellar and cardiac development: a comparison with ErbB2—and heregulin-deficient mice. Development 124, 4999–5011.
7. Sawyer, D.B., Zuppinger, C., Miller, T.A., Eppenberger, H.M., Suter, T.M., 2002.Modulation of anthracycline-induced myofibrillar disarray in rat ventricular myocytes by neuregulin-1beta and anti-erbB2: potential mechanism for trastuzumab-induced cardiotoxicity. Circulation 105 (13), 1551–1554.
8. Zhao, Y.Y., Sawyer, D.R., Baliga, R.R., et al., 1998. Neuregulins promote survival and growth of cardiac myocytes: persistence of ErbB2 and ErbB4 expression in neonatal and adult ventricular myocytes. J. Biol. Chem. 273 (17), 10261–10269.
9. Strasser, F., Betticher, D.C., Suter, T.M., 2001. Trastuzumab and breast cancer. N.Engl. J. Med. 345 (13), 996.
10. Jiang, Z., Zhou, M., 2010. Neuregulin signaling and heart failure. Curr. Heart Fail.Rep. 7 (1), 42–47.
11. Pentassuglia, L., Graf, M., Lane, H., Kuramochi, Y., Cote, G., Timolati, F., Sawyer, D.B.,Zuppinger, C., 2009. Inhibition of ErbB2 by receptor tyrosine kinase inhibitors causes myofibrillar structural damage without cell death in adult rat cardiomyocytes. Exp. Cell Res. 315, 1302–1312.
12. Sandoo, A., van Zanten, J.J., Metsios, G.S., Carroll, D., Kitas, G.D., 2010. The endothelium and its role in regulating vascular tone. Open Cardiovasc. Med. J.4, 302–312.
13. Strasser, F., Betticher, D.C., Suter, T.M., 2001. Trastuzumab and breast cancer. N.Engl. J. Med. 345 (13), 996
14. Feldman, A.M., Koch, W., Force, T.L., 2007. Developing strategies to link basic cardiovascular sciences with clinical drug development: another opportunity for translational sciences. Clin. Pharmacol. Ther. 81, 887–892.
15. Lemmens, K., Segers, V.F., Demolder, M., De Keulenaer, G.W., 2006. c Role ofneuregulin-1/ErbB2 signaling in endothelium-cardiomyocyte cross-talk. J. Biol.Chem. 281 (28), 19469–19477.
16. ElZarrad, M.K., Mukhopadhyay, P., Mohan, N., et al., 2013. Trastuzumab alters the expression of genes essential for cardiac function and induces ultrastructural changes of cardiomyocytes in mice. PLoS One 8 (11), e79543.
17. Ewer, S.M., Ewer, M.S., 2008. Cardiotoxicity profile of trastuzumab. Drug Saf. 31 (6),459–467
18. Slamon DJ, Leyland-Jones B, Shak S, Fuchs H et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med 344:783–792, 2001
19. Slamon D, Eiermann W, Robert N, Pienkowski T et al. Adjuvant trastuzumab in HER2-positive breast cancer. N Engl J Med 365:1273–1283, 2011
20. Baselga, J., Tripathy, D., Mendelsohn, J., Baughman S et al. 1996. Phase II study of weekly intravenous recombinant humanized anti-p185HER2 monoclonal antibody in patients with HER 2/neu−oevrexpressing metastatic breast cancer. J. Clin. Oncol. 14, 737–744. 1996.
21. Pegram, M.D., Lipton, A., Hayes, D.F., Weber, B.L et al. Phase II study of receptor enhanced chemosensitivity using recombinant humanizedanti-p185HER2/neu monoclonal antibody plus cisplatin in patients with HER2/neu−overexpressing metastatic breast cancer refractory to chemotherapy treatment. J. Clin. Oncol. 16, 2659–2671. 1998
22. Seidman, A., Hudis, C., Pierri, M.K., et al., 2002. Cardiac dysfunction in the trastuzumab clinical trials experience. J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol.20 (5), 1215–1221
23. Gianni, L., Eiermann, W., Semiglazov, V., Manikhas, A. Neoadjuvant chemotherapy with trastuzumab followed by adjuvant trastuzumab versus neoadjuvant chemotherapy alone, in patients with HER2−positive locally advanced breast cancer (the NOAH trial): a randomized controlled superiority trial with a parallel HER2−negative cohort. Lancet 375 (9712), 377–384.2010
24. Buzdar, A., Valero, V., Ibrahim, N., et al. Neoadjuvant therapy with paclitaxel followed by 5-fluouracil, epirubicin and cyclophosphamide chemotherapy and concurrent trastuzumab in human epidermal growth factor receptor 2 positive operable breast cancer: an update of the initial randomized study population and data of additional patients treated with the same regimen. Clin. Cancer Res. 13 (1), 228–233. 2007
25. Piccart-Gebhart, M., Procter, M., Leyland- Jones, B., et al.. Trastuzumab after adjuvant chemotherapy in HER 2 positive breast cancer. N. Eng. J. Med. 353,1659–1672.2005
26. Telli, M.L., Witteles, R.M., Trastuzumab-related cardiac dysfunction. J. Natl. Compr. Canc. Netw.: JNCCN 9 (2), 243–249. 2011.
27. Telli, M.L., Hunt, S.A., Carlson, R.W., Guardino, A.E., 2007. Trastuzumab-related cardiotoxicity: calling into question the concept of reversibility. J. Clin. Oncol.25 (23), 3525–3533.
28. Tan-Chiu, E., Yothers, G., Romond, E., et al., Assessment of cardiac dysfunction in a randomized trial comparing doxorubicin and cyclophosphamide followed by paclitaxel, with or without trastuzumab as adjuvant therapy in node-positive, human epidermal growth factor receptor 2overexpressing breast cancer:NSABP B-31. J. Clin. Oncol. 23, 7811–7819.2005
29. Perez, E.A., Suman, V., Davidson, N.E., et al., Cardiac safety analysis of doxorubicin and cyclophosphamide followed by paclitaxel with or without trastuzumab in the North Central cancer treatment group N9831 adjuvant breast cancer trial. J. Clin. Oncol. 26, 1231–1238. 2008
30. Joensuu, H., Kellokumpu-Lentinen, P., Bono, P., Adjuvant docetaxel or vinorelbine with or without trastuzumab for breast cancer. N. Eng. J. Med. 354(8), 809–820.2006
31. Bird, B.R., Swain, S.M., Cardiac toxicity in breast cancer survivors: review of potential cardiac problems. Clin. Cancer Res. 14 (1), 14–24.2008
32. Suter, T.M., Procter, M., van Veldhuisen, D.J., et al., Trastuzumab-associated cardiac adverse effects in the herceptin adjuvant trial. J. Clin. Oncol. 25 (25),3859–3865.2007.
33. Chavez-MacGregor, M., Zhang, N., Buchholz, T.A., et al.,Trastuzumab-related cardiotoxicity among older patients with breast cancer. J. Clin. Oncol. 31 (33),4222–4228.2013
34. Francis, S.A., Cheng, S., Arteaga, C.L., Moslehi, J., Heart failure and breast cancer therapies: moving towards personalized risk assessment. J. Am. HeartAssoc. 3 (1), e000780. 2014
35. McArthur, H.L., Chia, S., Cardiotoxicity of trastuzumab in clinical practice. N.Engl. J. Med. 357 (1), 94–95. 2007
36. Horie T, Ono K, Nishi H et al. Acute doxorubicin cardiotoxicity is associated with miR-146a-induced inhibition of the neuregulin- ErbB pathway. Cardiovasc Res 87:656–664. 2010
37. Gabrielson K, Bedja D, Pin S. et al. Heat shock protein 90 and ErbB2 in the cardiac response to doxorubicin injury. Cancer Res 67:1436–1441. 2007
38. Quartino AL, Hillenbach C, Li J et al. Population pharmacokinetic and exposure-response analysis for trastuzumab administered using a subcutaneous “manual syringe” injection or intravenously in women with HER2-positive early breast cancer. Cancer Chemother Pharmacol 77:77–88. 2016
39. Pivot X, Suter T, Nabholtz JMet al. Cardiac toxicity events in the PHARE trial, an adjuvant trastuzumab randomised phase III study. Eur J Cancer 51:1660–1666. 2015
40. Earl HM, Vallier AL, Dunn J, et al. Trastuzumab- associated cardiac events in the Persephone trial. Br JCancer 115:1462–1470.2016
41. Agus, D.B., Gordon, M.S., Taylor, C., et al., Phase I clinical study ofpertuzumab, a novel HER dimerization inhibitor, in patients with advancedcancer. J. Clin. Oncol. 23 (11), 2534–2543.2005
42. Yamamoto, N., Yamada, Y., Yutaka, F.,Phase I and pharmacokinetic study ofHER 2 targeted rhuMAB 2C4 (Pertuzumab, RO4368451) in Japanese patientswith solid tumors. Jpn. J. Clin. Oncol. 39 (4), 260–266.2009
43. Gianni, L., Pienkowski, T., Im, Y.H. et al. Efficacy and safety of neoadjuvant pertuzumaband trastuzumab in women with locally advanced, inflammatory, or earlyHER2-positive breast cancer (NeoSphere): a randomized multicentre,open-label, phase 2 trial. Lancet Oncol. 13, 25–32. 2012
44. Baselga, J., Gelmon, K.A., Verma, S. Phase II trial of pertuzumab andtrastuzumab in patients with human epidermal growth factor receptor 2positive metastatic breast cancer that progressed during prior trastuzumabtherapy. J. Clin. Oncol. 28 (7), 1138–1144.2010
45. Baselga, J., Cortes, J., Kim, S.B., et al. Pertuzumab plus trastuzumab plus docetaxel for metastatic breast cancer. N. Engl. J. Med. 366 (2), 109–119. 2012
46. Swain, S.M., Ewer, M.S., Cortes, J., et al. Cardiac tolerability of pertuzumab plus trastuzumab plus docetaxel in patients with HER2-positive metastatic breast cancer in CLEOPATRA: a randomized, double-blind, placebo-controlled phase III study. Oncologist 18 (3), 257–264.2013
47. Lenihan, D., Suter, T.M., Brammer, M. et al.Pooled anaylsis of cardiac safety in patients with cancer treated with pertuzumab. Ann. Oncol. 23, 791–800.2012
48. Franklin MC, Carey KD, Vajdos FF. et al. Insights into ErbB signaling from the structure of the ErbB2-pertuzumab complex. Cancer Cell 5:317–328.2004
49. Verma, S., Miles, D., Gianni, L., et al., Trastuzumab emtansine forHER2-positive advanced breast cancer. N. Engl. J. Med. 367 (19), 1783–1791. 2012
50. Krop, I.E., Kim, S.B., Gonzalez-Martin, A. et al. Trastuzumab emtansine versus treatment of physician’s choice for pretreated HER2-positiveadvanced breast cancer (TH3RESA): a randomized open label phase 3 trial. Lancet Oncol. 15 (7), 689–699.2014
51. Perez EA, Barrios C, Eiermann W, et al. Trastuzumab emtansine with or without pertuzumab versus trastuzumab plus taxane for human epidermal growth factor receptor 2-positive, advanced breast cancer: primary results from the Phase III MARIANNE study. J Clin Oncol 35(2):141–148
52. Vici P, Pizzuti L, Michelotti Aet al. A retrospective multicentric observational study of trastuzumab emtansine in HER2 positive metastatic breast cancer: a real-world experience. Oncotarget 8(34):56921–56931.
53. von Minckwitz G, Huang C-S, Mano MS,et al. Trastuzumab Emtansine for Residual Invasive HER2-Positive Breast Cancer. N Engl J Med 2019; 380:617-628. 2019.
54. Zamorano JL, Lancellotti P, Rodriguez Muñoz D, et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC). Eur J Heart Fail 2017;19:9-42.
55. Geyer, C.E., Forster, J., Lindquist, D., et al. Lapatinib plus capecitabine forHER2-positive advanced breast cancer. N. Engl. J. Med. 355 (26), 2733–2743.2006
56. Blackwell, K.L., Burstein, H.J., Storniolo, A.M., et al. Randomized study of Lapatinib alone or in combination with trastuzumab in women withErbB2-positive, trastuzumab-refractory metastatic breast cancer. J. Clin. Oncol.28 (7), 1124–1130. 2010
57. Johnston, S., Pippen, J.J., Pivot, X. Lapatinib combined with letrozole versusletrozole and placebo as first-line therapy for postmenopausal hormonereceptor-positive metastatic breast cancer. J. Clin. Oncol. 27, 5538–5546. 2009
58. Choi HD, Chang MJ Cardiac toxicities of lapatinib in patients with breast cancer and other HER2-positive cancers: a meta-analysis. Breast Cancer Res Treat (2017.) 166:927–936. 2017
59. Burstein HJ, Sun Y, Dirix LY, et al. Neratinib, an irreversible ErbB receptor tyrosine kinase inhibitor, in patients with advanced ErbB2-positive breast cancer. J Clin Oncol 28(8):1301–1307. 2010
60. Awada A, Colomer R, Inoue K, et al. Neratinib plus paclitaxel vs trastuzumab plus paclitaxel in previously untreated metastatic ERBB2-positive breast cancer: the NEfERT-T randomized clinical trial. JAMA Oncol 2(12):1557–1564.2016
61. Chan A, Delaloge S, Holmes FA, et al. ExteNET Study Group Neratinib after trastuzumab-based adjuvant therapy in patients with HER2-positive breast cancer (ExteNET): a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 17(3):367–377. 2016
62. Martin M, Holmes FA, Ejlertsen B, et al. ExteNET Study Group (2017) Neratinib after trastuzumab-based adjuvant therapy in HER2-positive breast cancer (ExteNET): 5-year analysis of a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 18(12):1688–1700.2017
63. Nerlynx (neratinib) [package insert] (2017). Puma Biotechnology, Los Angeles, CA
64. Cardinale D, Caruso V, Cipolla CM. The breast cancer patient in the cardioncology unit. J Thorac Dis 2018;10(Suppl 35):S4306-S4322. 2018
65. Piccart-Gebhart M, Procter M, Leyland-Jones B, et al. Trastuzumab after adjuvant chemotherapy in HER-2 positive breast cancer. N Engl J Med 2005;353:1659–72.
66. Romond EH, Perez EA, Bryant J, et al. Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer. N Engl J Med 2005;353:1673–84.
67. Bouchardy C, Rapiti E, Fioretta G, et al. Undertreatment strongly decreases prognosis of breast cancer in elderly women. J Clin Oncol 2003; 21: 3580–87.
68. Biganzoli L,Wildiers H, Oakman C, et al. Management of elderly patients with breast cancer: updated recommendations of the International Society of Geriatric Oncology (SIOG) and European Society of Breast Cancer Specialists (EUSOMA). Lancet Oncol 2012; 13:e148–60.
69. E. Brain, P. Caillet, N. de Glas, et al., HER2-targeted treatment for older patients with breast cancer: An expert position paper from the An expert position paper from the International Society of Geriatric Oncology. J Geriatr Oncol. 2019 Nov;10(6):1003-1013.
70. Satariano WA, Ragland DR. The effect of comorbidity on 3-year survival of women with primary breast cancer. Ann Intern Med 1994; 120: 104–10
71. Tolaney SM, Barry WT, Guo H, et al. Seven-year (yr) follow-up of adjuvant paclitaxel (T) and trastuzumab (H) (APT trial) for node-negative, HER2-positive breast cancer (BC). ASCO; 2017 [Abstract 511].
72. Sawaki M, Saito T, Baba S, et al. Evaluation of trastuzumab without chemotherapy asa postoperative adjuvant therapy in HER2-positive elderly breast cancer patients: randomized controlled trial (RESPECT). J Clin Oncol 2018;36 [suppl; abstr 510].
73. Cardoso F, Costa A, Senkus Eet al. 3rd ESO-ESMO international consensus guidelines for Advanced Breast Cancer (ABC 3). Ann Oncol 28(1):16–33.2017
74. National Comprehensive Cancer Network Breast Cancer (Version 3.2017). https://www.nccn.org/professionals/physician_gls/pdf/breast.pdf. Accessed 22 Feb 2019
75. Armenian SH, Lacchetti C, Barac A, et al. Prevention and monitoring of cardiac dysfunction in survivors of adult cancers: American Society of Clinical Oncology clinical practice guideline. J Clin Oncol 35(8):893–911. 2017
76. Lynce F, Barac A, Tan MT, et al. SAFE-HEaRt: rationale and design of a pilot study investigating cardiac safety of HER2 targeted therapy in patients with HER2-positive breast cancer and reduced left ventricular function. Oncologist 22(5):518–525. 2017
77. Cardinale D, Colombo A, Torrisi R, et al. Trastuzumab induced cardiotoxicity: clinical and prognostic implications of Troponin I evaluation. J Clin Oncol 2010;28:3910-16.
78. Sawaya H, Sebag IA, Plana JC, et al. Early detection and prediction of cardiotoxicity in chemotherapy-treated patients. Am J Cardiol 2011;107:1375-80
79. Guenancia C, Lefevbvre A, Cardinale D, et al. Obesity as a risk factor for anthracyclines and trastuzumab cardiotoxicity in breast cancer: a systematic review and meta-analysis. J Clin Oncol 2016;34:3157-65.
80. Jerusalem G, Lancellotti P, Kim S-B HER2+ breast cancer treatment and cardiotoxicity: monitoring and management. Vol.:(0123456789)1 3Breast Cancer Research and Treatment (2019) 177:237–250
Autorka: dr n med. Agnieszka Jagiełło-Gruszfeld, jest onkologiem klinicznym, pracuje w Klinice Nowotworów Piersi i Chirurgii Rekonstrukcyjnej w Narodowym Instytucie Onkologii im. Marii Skłodowskiej-Curie w Warszawie. Państwowy Instytut Badawczy. Zawodowo koncentruje się na leczeniu chorych na raka piersi. Szczególnie interesuje się onkologią geriatryczną. Od ponad 10 lat jest członkiem SIOG (International Society of Geriatric Oncology), obecnie reprezentantem Polski w tej organizacji. Jest także członkiem PTO, PTOK, ESMO, ASCO.


