Późne działania niepożądane leczenia onkologicznego u kobiet z nowotworem piersi. Wprowadzenie działań profilaktycznych i korygujących.
Artykuł powstał w ramach projektu
pt.: „Wydawnictwa dla Amazonek”,
który realizowany jest dzięki dofinansowaniu
z Państwowego Funduszu Rehabilitacji Osób Niepełnosprawnych

Międzynarodowy Zespół Ekspertów oszacował, że na świecie w roku 2018 liczba zachorowań na nowotwory wynosiła ponad 18 milionów z czego 20% stanowiły przypadki z Europy. Najczęściej diagnozowanym nowotworem w Europie wśród kobiet jest rak piersi i stanowi on prawie 30% przypadków. Co prawda od początku lat 70 (XX wieku) “przodował” rak szyjki macicy jednak z upływem czasu stwierdzono spadek częstotliwości występowania tego nowotworu wraz z szybkim wzrostem zachorowalności na nowotwór piersi oraz kolejno nowotwory jelita grubego oraz płuca. W ciągu ostatnich pięćdziesięciu lat standaryzowany współczynnik zachorowalności zwiększył się czterokrotnie (23/105 vs 91/105). Najnowsze trendy zachorowalności na raka piersi oraz inne nowotwory zostały przedstawione w najnowszym raporcie “Sytuacja zdrowotna ludności i jej uwarunkowania 2020” przygotowanym przez Narodowy Instytut Zdrowia Publicznego oraz Państwowy Zakład Higieny.
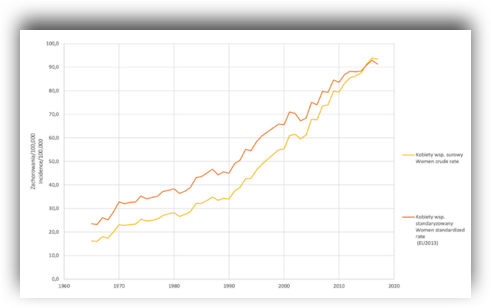
Trendy zachorowalności na raka piersi, Polska 1965-2017.
Źródło: Sytuacja zdrowotna ludności Polski i jej uwarunkowania 2020. Pod redakcją Bogdana Wojtyniaka i Pawła Goryńskiego. Narodowy Instytut Zdrowia Publicznego. Państwowy Zakład Higieny, Warszawa 2020.
Wśród młodych kobiet w wieku 20 do 44 lat nowotwory piersi nie występują zbyt często jednak warto pamiętać, że ryzyko wzrasta wraz z wiekiem. Uwzględniając miejsce zamieszkania okazuje się, że wśród mieszkanek miast zachorowalność na raka piersi jest wyższa we wszystkich grupach wiekowych w porównaniu do kobiet zamieszkujących wieś. Równie niepokojący jest fakt, że wykazano tendencję wzrostową zachorowania na nowotwór piersi bez względu na miejsce zamieszkania. Analiza ww. raportu dotyczącego sytuacji zdrowotnej ludności Polski wykazała, że od roku 1999 do roku 2019 wartość standaryzowanego współczynnika zachorowalności wśród kobiet mieszkających w mieście wzrosła o około 30%, a wśród mieszkanek wsi o niemal dwukrotnie – o 57%.
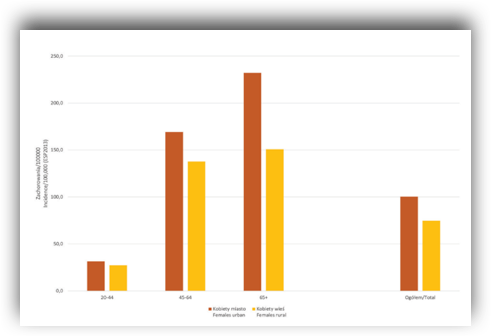
Zachorowalność na raka piersi Polska 2017.
Źródło: Sytuacja zdrowotna ludności Polski i jej uwarunkowania 2020. Pod redakcją Bogdana Wojtyniaka i Pawła Goryńskiego. Narodowy Instytut Zdrowia Publicznego. Państwowy Zakład Higieny, Warszawa 2020.
Pomimo tego, że w ostatnich latach obserwuje się stały wzrost zachorowalności na raka piersi to pozytywną stroną tej sytuacji jest spadek umieralności spowodowany tym nowotworem. Związane jest to nie tylko ze zwiększoną częstotliwością wykrywania zmian w początkowym stadium, ale również stosowania systemowego i miejscowego leczenia, które wraz z zabiegiem operacyjnym zwiększa skuteczność procesu leczniczego.
Oczywiście w większości przypadków analizowanych publikacji dane pochodzą z przed czasów pandemii, dlatego też ciężko jest opisać realny wpływ obecnej sytuacji na zachorowalność oraz umieralność na nowotwory piersi. Jedno jest pewne, w niektórych województwach liczba mammografii spadła o ponad 90%, a cytologii o nawet 95%, a z informacji NFZ wynika, że w poprzednim roku wydano o kilkanaście tysięcy mniej kart DiLO niż w roku 2019. Informacje te niestety nie napawają optymizmem.
Obecne możliwości leczenia nowotworów piersi dają nam możliwości opieki nad chorą przez cały wielodyscyplinarny zespół, w skład którego powinni wchodzić onkolodzy kliniczni, chirurdzy onkologiczni, radioterapeuci, patolodzy, ale również zespół, który koordynuje terapie wspierające (m.in. dietetyk, psycholog, fizjoterapeuta). Niestety z naszej obecnej wiedzy wynika, że obszar terapii wspierających jest mocno zaniedbany. Trzydziesto -minutowa konsultacja psychologiczna przy łóżku chorego nie pomoże uporać się z tą trudną sytuacją. Standardowe zalecenia żywieniowe (dla wszystkich takie same) nie poprawią stanu odżywienia i samopoczucia, a ćwiczenia napisane na kartce nie poprawią mobilności chorej. Niestety taka jest smutna rzeczywistość zarówno w trakcie diagnozy, podczas leczenia czy po jego zakończeniu – a pacjentki potrzebują tego wsparcia na każdym etapie.
Podczas diagnostyki oraz momentu rozpoznania cała uwaga skupia się na ustaleniu planu leczenia, aby osiągnąć jak najlepszy efekt terapeutyczny – wyleczenie pacjentki. To nie podlega dyskusji, natomiast to już ten moment, w którym powinien również działać zespół: dietetyk, psycholog oraz fizjoterapeuta. Poprzez odpowiednio dobrany system żywieniowy oraz modyfikację stylu życia jesteśmy w stanie lepiej przygotować organizm do leczenia, a tym samym zmniejszać lub niwelować skutki uboczne zastosowanego leczenia. Do wczesnych działań niepożądanych głównie zalicza się mdłości, wymioty, utratę włosów, zespół przewlekłego zmęczenia czy mielosupresję (zmniejszenie liczby komórek szpiku kostnego). Podczas rozpoczętego leczenia onkologicznego nadrzędnym celem jest wyleczenie oraz możliwa poprawa samopoczucia, ale kiedy skutki uboczne są dotkliwe to bardzo rzadko zwraca się uwagę na odległe powikłania terapii onkologicznej. Stanowią one problem w grupie pacjentów wyleczonych – ponieważ późne powikłania leczenia przeciwnowotworowego może w znaczący sposób obniżać jakość życia po chorobie. Dlatego też niezbędne jest już podczas planowania leczenia rozważenie ewentualnych późnych działań niepożądanych takich jak:
- kardiotoksyczność,
- neurotoksyczność,
- osteoporoza,
- oraz zaburzenia funkcji rozrodczych, przedwczesna menopauza czy wtórne nowotwory szpiku kostnego.
Późne działania niepożądane leczenia onkologicznego u kobiet z nowotworem piersi oraz możliwe działania profilaktyczne.
KARDIOTOKSYCZNOŚĆ
Coraz większym problemem terapeutycznym na świecie staje się kardiotoksyczność uzupełniającego leczenia pooperacyjnego u kobiet po przebytym nowotworze piersi. Wiąże się ono z tym, że leczenie onkologiczne ma nie tylko działanie przeciwnowotworowe, ale również ma działania niepożądane. Powikłania kardiologiczne (kardiotoksyczność) mogą wystąpić zarówno jako skutek radioterapii jak i chemioterapii.
Wpływ radioterapii na powikłania kardiologiczne jest dobrze udokumentowany w literaturze i w głównej mierze dotyczy wpływu na układ sercowo-naczyniowy, może również powodować trwałą utratę masy mięśnia sercowego, nadciśnienie tętnicze, chorobę niedokrwienną serca, zaburzenia rytmu serca i przewodzenia oraz sprzyjać zakrzepom i zatorom oraz miażdżycy. Kardiotoksyczność może dotyczyć epizodów ostrych (występujących podczas leczenia lub do roku po jego zakończeniu i najczęściej dotyczy osierdzia oraz zastawek serca) oraz przewlekłych (po roku od zakończenia leczenia i dotyczy naczyń wieńcowych, mięśnia sercowego czy układu przewodzącego serca).
Podobnie jak w przypadku radioterapii udokumentowano również toksyczność leków przeciwnowotworowych w szczególności wysoką kardiotoksyczność w grupie leków należących do cytostatyków – antracyklin. Ich przewlekła kardiotoksyczność występuje rok po zakończonym leczeniu i najczęściej manifestuje się niewydolnością serca lub subklinicznym uszkodzeniem mięśnia sercowego. Późne objawy kardiotoksyczności mogą wystąpić nawet po 25 latach od zakończonego leczenia (chemioterapii).
Dodatkowe czynniki ryzyka uszkodzenia mięśnia sercowego w trakcie terapii onkologicznej pacjentek z nowotworem piersi.
- choroba serca w wywiadzie,
- cukrzyca,
- choroba wątroby,
- niewydolność nerek,
- wysokie dawki kumulacyjne cytostatyków,
- radioterapia poprzedzająca lub współistniejąca (>20 Gy),
- chemioterapia w wywiadzie,
- równoczesne stosowanie różnych leków onkologicznych (np. antracykliny z trastuzumabem),
- wiek > 65 r.ż.,
- płeć żeńska.
Rekomendacje opieki internistycznej i kardiologicznej dla kobiet chorujących na nowotwór piersi z komentarzem.
• Całkowite wyeliminowanie aktywnego i biernego palenia papierosów, w tym aspekcie niezbędne może się okazać wsparcie psychologiczne poprzez pracę nad skutecznością wprowadzonych nawyków długoterminowych.
• Utrzymywania optymalnego ciśnienia tętniczego krwi <130/80 mmHg. Na parametry ciśnienia tętniczego ma wpływ zarówno dieta jak i styl życia. Odpowiedni dobór produktów (np. żywność bogata w potas, uboga w sód – jeśli nie ma przeciwwskazań) potencjalnie poprawi parametry ciśnienia. Również nadwaga i otyłość nie sprzyjają prawidłowym wynikom pomiarów ciśnienia tętniczego, dlatego też niezwykle ważnym aspektem będzie utrzymanie prawidłowej masy ciała w czym pomoże indywidualnie dostosowana aktywność fizyczna oraz dieta.
• Poprawa parametrów profilu lipidowego poprzez stosowanie odpowiedniej diety z ograniczeniem: żywności wysokoprzetworzonej, produktów zwierających duże ilości rafinowanych cukrów oraz smażenia w głębokim tłuszczu na korzyść produktów bogatych w błonnik, zwiększone ilości warzyw oraz owoców niskowęglowodanowych (jagodowych) oraz dodatek zdrowych tłuszczów np. orzechów włoskich, siemienia lnianego czy oliwy z oliwek oraz w razie potrzeby leków hipolipemizujących.
• Utrzymywania prawidłowej masy ciała. Niezwykle ważny element w profilaktyce układu sercowo-naczyniowego. Jednak ewentualna redukcja masy ciała powinna być prowadzona pod nadzorem specjalisty dietetyka, aby nie doprowadzić do niedoborów ilościowych oraz jakościowych, a także zapobiegać utracie beztłuszczowej masy ciała.
• Dbania o prawidłowe stężenie glikemii. Bardzo ważne w tym zakresie jest wprowadzenie diety o niskim indeksie oraz ładunku glikemicznym z odpowiednią ilością błonnika pokarmowego. Również pomocnym działaniem będzie wprowadzenie aktywności fizycznej, która wpływa również pozytywnie na normalizację glikemii.
• U chorych z dodatkowymi czynnikami ryzyka powikłań zakrzepowo-zatorowych, którzy stosują leczenie przeciwkrzepliwe heparynami drobnocząsteczkowymi, należy wziąć pod uwagę zalecenia dietetyczne uwzględniające umiarkowane spożycie produktów bogatych w witaminę K (np. zielonolistne, kapustne, awokado).
Pomimo tego, że z każdym rokiem wprowadzane są nowe standardy i techniki leczenia nowotworów (zarówno w radioterapii jak i chemioterapii), które pozwalają osiągać lepsze wyniki leczenia oraz oszczędność narządów krytycznych to nadal niestety powodują powikłania kardiologiczne. Dlatego też niezwykle ważne jest, aby pacjentki onkologiczne były poddawane szczegółowej obserwacji oraz kontroli kardiologicznej.
NEUROTOKSYCZNOŚĆ
Równie częstym powikłaniem leczenia przeciwnowotworowego są powikłania neurologiczne, ich występowanie może być również związane z samym procesem nowotworowym. Największe ryzyko powikłań (neurotoksyczności) wykazano podczas stosowania alkaloidów barwnika, cisplatyny, ifosfamidu oraz w dużych dawkach: metotreksatu i cytarabiny. Nieco mniejsze zagrożenie występowania neurotoksyczności wykazano stosując np.: fluorouracyl, prokarbazyny czy asparaginazy. Niestety leki nowej generacji (paklitaksel, docetaksel, pentostatyna) wprowadzone w ostatnich latach również mogą powodować powikłani neurologiczne.
Objawy neurotoksyczne towarzyszące leczeniu można podzielić na 4 rodzaje.
1. Polineuropatia obwodowa – uszkodzenie obwodowej części nerwu może powodować spontaniczne wyładowania w nocyceptorach (receptorach bólowych) prowadząc do powstania bólu neuropatycznego, którego występowania znacznie pogarsza jakość życia chorego.
Charakterystyczne symptomy polineuropatii obwodowej: zanik odruchów ze ścięgna Achillesa i kolanowego, zaburzenia czucia w kończynach górnych i dolnych, a w dalszym etapie bóle, osłabienie mięśniowe oraz zaburzenia chodu. Skutki uboczne w postaci polineuropatii obwodowej mogą trwać od 6 do 8 tygodni i zazwyczaj są odwracalne.
2. Neuropatia w zakresie autonomicznego układu nerwowego – najbardziej niebezpiecznym typem neuropatii w zakresie układu autonomicznego jest porażenna niedrożność jelit. Dlatego też nie należy bagatelizować falowo narastających bólów brzucha, nudności, wymiotów, zatrzymania gazów i stolca oraz znacznego wzdęcia brzucha, a także wzmożonego napięcia brzusznego, bólu przy próbie kaszlu oraz współwystępującej gorączki. Do rzadziej występujących objawów uszkodzenia układu autonomicznego należą np. zatrzymanie moczu czy impotencja.
3. Neuropatia nerwów czaszkowych – w rzadkich wypadkach może powodować upośledzenie wzroku lub podwójne widzenie. Neuropatia może obejmować również nerw trójdzielny którego objawami może być silny ból żuchwy. Symptomy uszkodzenia nerwów czaszkowych są zwykle obustronne.
4. Encefalopatia – przykładowe objawy to zmiany zachowania, afazja (zaburzenia) czy halucynacje wzrokowe, zaburzenia świadomości, stany depresyjne, senność czy też bezsenność.
Częstość występowania i nasilenia neurotoksyczności zależne są:
- od wieku chorego,
- zaawansowania procesu nowotworowego,
- liczby kursów podaży leków,
- zastosowanych cytostatyków oraz ich sumarycznej dawki.
Dodatkowe czynniki zwiększające ryzyko neurotoksyczność:
- napromienianie OUN,
- cukrzyca,
- współistnienie innych schorzeń neurologicznych,
- uszkodzenie bariery krew mózg niezależnie od etiologii.
Większość powikłań neurologicznych mija jednak, jeśli odpowiednio wcześnie nie zostaną rozpoznane może dojść do pogłębienia zmian oraz ich utrwalenia.
Niestety na chwilę obecną nie posiadamy wiarygodnych naukowo metod radzenia sobie z neurotoksycznością leczenia onkologicznego. Jedynym z leków, którego działanie zostało udowodnione jest duloxetyna.
Z publikacji naukowych wynika, że skuteczne w zapobieganiu i leczeniu zaburzeń funkcji poznawczych są: treningi kognitywne oraz aktywność fizyczna, natomiast nie wykazano skuteczności: substancji psychostymulujących oraz ginko-biloba.
Co ciekawe witamina E ma ochronne działanie w stosunku do nerwów obwodowych w przypadkach chorych leczonych cisplatyną i taksanami. Jeśli nie ma przeciwwskazań warto uzupełnić dietę o produkty bogate w witaminę E takie jak: nasiona, pestki, orzechy włoskie, zarodki pszenicy, dobrej jakości oleje roślinne dodawane na zimno do potraw oraz produkty pełnoziarniste i oliwki. Ryzyko encefalopatii można obniżyć włączając produkty bogate w kwas foliowy (zielonolistne produkty: szpinak, sałata, kapusta, brokuł, zielony groszek czy buraki oraz orzechy i ziarna zbóż).
OSTEOPOROZA
Osteoporoza jest układową chorobą szkieletu, której następstwami mogą być złamania kości, które są skutkiem zmniejszania ich odporności mechanicznej. Odpowiedzialne za odporność mechaniczną kości jest gęstość mineralna jak i jakość tej tkanki. Niestety leczenie onkologiczne działa nie tylko przeciwnowotworowo, a obok kardiotoksyczności oraz neurotoksyczności bardzo często dochodzi również do powikłań w układzie kostnym, czyli osteoporozy. Za taki skutek odpowiedzialnych jest wiele różnych mechanizow, aczkolwiek najbardziej narażone są kobiety przed menopauzą. Zastosowanie tamoxifenu u wcześniej wspomnianych kobiet znacznie nasila osteopenię (obniżenie gęstości mineralnej kości) oraz osteoporozę inaczej niż u kobiet po menopauzie, gdzie wykazuje działanie ochronne.
Aby zapobiegać późnym powikłaniom w postaci osteoporozy w trakcie terapii należy:
- regularnie monitorować stan gęstości kości (densytometria, RTG),
- wprowadzić regularną aktywność fizyczną indywidualnie dostosowaną do możliwości chorej, najlepiej po edukacji przez fizjoterapeutę,
- indywidualnie suplementować wapń oraz witaminę D3 według wskazań lekarza na podstawie badań biochemicznych krwi.
Z ostatnich publikacji wynika również, że stosowanie bifosfonianów w leczeniu uzupełniającym u kobiet po menopauzie może przynosić korzyści.
Podsumowanie
Z publikacji naukowych, które oceniały jakość życia pacjentek onkologicznych po leczeniu wynika, że doświadczają one wielu powikłań związanych z zastosowanym leczeniem. Głownie były to zaburzenia snu oraz zaburzenia funkcji poznawczych blisko 40% kobiet, tyle samo kobiet zaobserwowało dolegliwości związane z menopauzą, prawie taki sam odsetek kobiet miał problem z dolegliwościami związanymi układem kostno-stawowym, jedna trzecia doświadczała zespołu zmęczenia a co piąta kobieta – polineuropatii. W obecnej sytuacji należy mieć na uwadze nie tylko stosowane leczenie onkologiczne, ale również późne powikłania, które po zakończonym leczeniu mogą znacząco obniżać jakość życia pacjentek po wyleczeniu nowotworu.
Bibliografia
Sytuacja zdrowotna ludności Polski i jej uwarunkowania 2020. Pod redakcją Bogdana Wojtyniaka i Pawła Goryńskiego. Narodowy Instytut Zdrowia Publicznego. Państwowy Zakład Higieny, Warszawa 2020.
Myśliwiec, P. (2019). Późne działania niepożądane uzupełniającego leczenia systemowego u chorych z rozpoznaniem raka piersi. Letters in Oncology Science, 16(1), 29-36.
Yeh E, Tong A, Lenihan D, Yusuf S, Swafford J, Champion C, et al. Cardiovascular complications of cancer therapy: Diagnosis, pathogenesis, and management. Circulation 2004.
Wittych, J., Wachowicz, M., Banatkiewicz, P., Mitura, S., & Gisterek, I. (2014). Kardiotoksyczność w leczeniu raka piersi. Inżynier i Fizyk Medyczny, 3(4), 209-213.
Armenian S, Lacchetti C, Barac A, Carver J, Constine L, Denduluri N, Prevention and Monitoring of Cardiac Dysfunction in Survivors of Adult Cancers: American Society of Clinical Oncology Clinical Practice Guideline. J Clin Oncol. 2017.
Adamska, A. J. (2017). Problem kardiotoksyczności radioterapii raka piersi. Letters in Oncology Science, 14(1), 16-21.
Tahover E, Segal A, Isacson R, Rosengarten O, Grenader T, Gips M et al. Dexrazoxane added to doxorubicin-based adjuvant chemotherapy of breast cancer: a retrospective cohort study with a comparative analysis of toxicity and survival. Anicancer Drugs. 2017.
Sidło-Stawowy, A., Sawicka, M., Kubeczko, M., Sikoń, E., Piszko, J., Maruszczyk, W., … & Bracik, J. (2013). Ocena kardiotoksyczności u pacjentek z rakiem piersi leczonych trastuzumabem. In Annales Academiae Medicae Silesiensis (Vol. 67, No. 2, pp. 123-127).
Gianni L, Munzone E, Capri G, Fulfaro F, Tarenzi E, Villani F et al. Paclitaxel by 3-hour infusion in combination with bolus doxorubicin in women with untreated metastatic breast cancer: high antitumor efficacy and cardiac effects in a dose-finding and sequence-finding study. J Clin Oncol. 1995.
Cameron D, Piccart-Gebhart M, Gelber R, Procter M, Goldhirsch A, de Azambuja E et al. 11 years’ followup of trastuzumab after adjuvant chemotherapy in HER2-positive early breast cancer: final analysis of the HERceptin Adjuvant (HERA) trial. Lancet. 2017.
Buzdar A, Howell A, Cuzick J, Wale C, Distler W, Hoctin-Boes G et al. Comprehensive side-effect profile of anastrozole and tamoxifen as adjuvant treatment for early-stage breast cancer: long-term safety analysis of the ATAC trial. Lancet Oncol. 2006.
Rogalska, A., Marczak, A., Szwed, M., Gajek, A., & Józwiak, Z. (2010). Epotilony-nadzieja dla pacjentów niewrazliwych na leczenie taksanami. Wspólczesna Onkologia, 14(3), 205.
[Opolski G, Krzakowski M, Postępowanie w powikłaniach sercowo-naczyniowych w raku piersi. Rekomendacje krajowego Nadzoru Kardiologicznego i Onkologicznego dotyczące bezpieczeństwa kardiologicznego u chorych na raka piersi, Medical Education sp.z o.o., Warszawa 2010.
Kim P, Johnson C. Chemotherapy-induced peripheral neuropathy: a review of recent findings. Curr Opin Anaesthesiol. 2017.
Łyskawa, W. Chemioterapia w leczeniu choroby nowotworowej i jej neurotoksyczność Chemiotherapy in the neoplasmatic diseases treatment and its neurotoxicity.
Meattini I, Desideri I, Francolini G, Vannini A, Perna M, Garlatti P et al. Systemic therapies and cognitive impairment for breast cancer: an overview of the current literature. Med Oncol. 2017.
Phillips K, Regan M, Ribi K, Francis P, Puglisi F, Bellet M et al. Adjuvant ovarian function suppression and cognitive function in women with breast cancer. Br J Cancer. 2016.
Wolff A, Blackford A, Visvanathan K, Rugo H, Moy B, Goldstein L et al. Risk of marrow neoplasms after adjuvant breast cancer therapy: the national comprehensive cancer network experience. J Clin Oncol 2015.
Zajączkowska, R., & Leppert, W. (2016). Leczenie bólu neuropatycznego u chorych na nowotwory. Medycyna Paliatywna w Praktyce, 10(1).
Vehmanen L, Elomaa I, Blomqvist C, Saarto T, Tamoxifen treatment after adjuvant chemotherapy has opposite effects on bone mineral density in premenopausal patients depending on menstrual status, J. Clin. Oncol. 2006.
Chwałczyńska, A., & Bolanowski, M. (2012). Występowanie obniżonej masy kostnej u kobiet z obrzękiem chłonnym leczonych z powodu raka piersi. Menopausal Review/Przeglad Menopauzalny, 11(6).
Hong A, Kim J, Lee K, Kim T, Im S, Kim T et al. Long-term effect of aromatase inhibitors on bone microarchitecture and macroarchitecture in non-osteoporotic postmenopausal women with breast cancer. Osteoporos Int. 2017.
Janiszewska, M., Kulik, T., Dziedzic, M., Żołnierczuk-Kieliszek, D., & Barańska, A. (2015). Osteoporoza jako problem społeczny–patogeneza, objawy i czynniki ryzyka osteoporozy pomenopauzalnej. Probl Hig Epidemiol, 96(1), 106-114.
Dhesy-Thind S, Fletcher G, Blanchette P, Clemons M, Dillmon M, Frank E et al. Use of Adjuvant Bisphosphonates and Other Bone-Modifying Agents in Breast Cancer: A Cancer Care Ontario and American Society of Clinical Oncology Clinical Practice Guideline. J Clin Oncol. 2017.
Autor: Polskie Stowarzyszenie Onkodietetyki – dr n o zdr Monika Ameryk, dr n med. Joanna Sikora


