„Kardiotoksyczność chemioterapii i leczenia celowanego u chorych na rak piersi.”
Artykuł powstał w ramach projektu pt.: „Wydawnictwa dla Amazonek”, który realizowany jest dzięki dofinansowaniu ze środków Państwowego Funduszu Rehabilitacji Osób Niepełnosprawnych

Od początku lat 80 obserwuje się gwałtowny wzrost zachorowalności na raka piersi we wszystkich grupach wiekowych. Skuteczniejsze metody rozpoznawania i leczenia chorób nowotworowych powodują, że zwiększa się jednocześnie odsetek całkowitych wyleczeń i wydłuża czas przeżycia chorych. Wiele pacjentek umrze z innych przyczyn niż rak piersi. Najczęściej będą to choroby sercowo-naczyniowe [1,2]. Podkreśla się, że powikłania sercowo naczyniowe u chorych na raka piersi wynikają głównie z zastosowania w leczeniu antracyklin, trastuzumabu i innych leków celowanych oddziałujących na receptor HER2 oraz radioterapii uzupełniającej [3]. Najwyższe prawdopodobieństwo wystąpienia powikłań sercowo-naczyniowych istnieje w grupie pacjentów z czynnikami ryzyka szczególnie nadciśnieniem tętnicze oraz wiek powyżej 70 lat. Zaznacza się wyraźnie wzrost ryzyka powikłań sercowo naczyniowych w grupie pacjentów, u których zastosowano w leczeniu klika potencjalnie kardiotoksycznych metod terapii (np. antracykliny i trastuzumab) [3,4].
Stosowanie obecnie terapie onkologiczne mogą w dwojaki sposób wywołać powikłania sercowo-naczyniowe: w sposób bezpośredni zakłócić czynność serca lub też przyśpieszyć rozwój chorób układu sercowo-naczyniowego, zwłaszcza w przypadku występowania innych czynników ryzyka u pacjenta [4].
Według członków Grupy Roboczej Europejskiego Towarzystwa Kardiologicznego do spraw toksycznego wpływu leczenia onkologicznego na układ sercowo-naczyniowy, powikłania leczenia onkologicznego można podzielić na 9 głównych kategorii [5]: dysfunkcja mięśnia sercowego i niewydolność serca (HF); choroba wieńcowa (CAD); wady zastawkowe (nie opisywane dotąd podczas leczenia cytostatykami i lekami celowanymi molekularnie); zaburzenia rytmu serca, zwłaszcza wywołane lekami wydłużającymi odstęp QT; nadciśnienie tętnicze; choroby zakrzepowo-zatorowe; choroba naczyń obwodowych i udar mózgu; nadciśnienie płucne i powikłania osierdziowe.
Dysfunkcja mięśnia serca i niewydolność serca należą do najpoważniejszych konsekwencji leczenia systemowego raka piersi [6,7]. Niektóre cytostatyki (antracykliny, antymetabolity, cyklofosfamid) mogą wywoływać trwałe uszkodzenie komórki mięśnia sercowego prowadzące do ostrej lub przewlekłej niewydolności serca. Najczęściej obserwujemy niewydolność serca po zastosowaniu antracyklin. Jest to toksyczność zależna od dawki i kumulacyjna. Częstość dysfunkcji lewej komory w przypadku terapii antracyklinami wynosi od 2% w przypadku stosowania antracykliny w postaci liposomalnej do 26% w przypadku zastosowania doksorubicyny w dawce 550mg/m2 [5,8]. Kardiotoksyczność antracyklin (kardiotoksyczność typu I) jest skutkiem stresu oksydacyjnego, w którym wytwarzanie reaktywnych form tlenu (ROS), a także w mniejszym stopniu reaktywnych form azotu (RNS), skutkuje uszkodzeniami strukturalnymi mięśnia sercowego. Powstały w tej reakcji rodnik hydroksylowy uszkadza błony lipidowe, białka oraz kwasy nukleinowe. Uszkodzenia te są szczególnie istotne w tkankach serca, co spowodowane jest niewielką ilością enzymów odpowiedzialnych za inaktywację ROS (głównie katalazy). Procesy te prowadzą do degradacji błon komórkowych, uszkodzeń na poziomie komórkowym, a procesy peroksydacji lipidów prowadzą dodatkowo do zjawisk mutagennych, co w efekcie skutkuje trwałym uszkodzeniem kardiomiocytów. [9-11].
U pacjentów leczonych antracyklinami i lekami celowanymi antyHER2 można zaobserwować dwa odrębne mechanizmy kardiotoksyczności: typ I i typ II.
Kardiotoksyczność typu I, związana z antracyklinami, jest zależna od dawki, nieodwracalna i związana ze zmianami strukturalnymi mięśnia serca. Kardiotoksyczność typu II, wynikająca z działania trastuzumabu i innych leków anyty-HER2 nie jest zależna od dawki, jest w dużej mierze odwracalna, ale może również powodować zmiany strukturalne w badaniu histologicznym kardiomiocytu [12]. Mechanizm powstania obu tych toksyczności jest odmienny i dlatego w przypadku skojarzenia antracyklin i leków celowanych anyHER2 dochodzi do kumulacji działań niepożądanych w układzie sercowo-naczyniowym [13].
Mechanizm kardiotoksyczności leków działających na receptor HER2 i antracyklin przedstawiono schemtycznie na ryc.1.
Rycina 1.
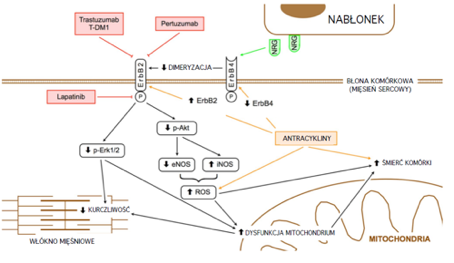
Ryzyko wystąpienia HF (która może wystąpić w ciągu godzin, tygodni lub lat po ekspozycji na antracykliny) wzrasta wraz ze skumulowaną dawką: 3-5% przy dawce 400 mg/m2, 7-26% przy dawce 550 mg/m2 i 18-48% przy dawce 700 mg/m2 doksorubicyny [14-16]. Częściej dochodzi do rozwoju poantracyklinowej objawowej HF u chorych bardzo młodych (<20 r.ż.)oraz w wieku powyżej 65 lat, a także u pacjentów po przebytej radioterapii klatki piersiowej oraz u osób z innymi czynniiami ryzyka chorób sercowo-naczyniowych [17]. Według danych SEER (ang. Surveillance, Epidemiology, and End Results) skumulowana częstość występowania HF po 10 latach wyniosła 38%, w przypadku zastosowania chemioterapii z antracyklinami, 32.5% po zastosowaniu schematów bez antracyklin, w porównaniu z 29% u chorych na raka piersi, nie otrzymujących chemioterapii [18,19].
Dysfunkcja mięśnia sercowego i niewydolność serca może również wystąpić w związku ze stosowaniem leczenia innymi cytostatykami np. cyklofosfamidem (7-28%)[20] i docetakselem (2.3-8%) [15]. Ryzyko wystąpienia kardiotoksyczności wynikające z zastosowania cytostatyków przedstawiono w tabeli 1.
Tabela1. Ryzyko wystąpienia kardiotoksyczności podczas stosowania leczenia cytostatycznego [18].
| Cytostatyk | Dawka | Rodzaj kardiotoksyczności | Częstość występowania |
| Doksorubicyna | >450mg/m2 | Dysfunkcja lewej komory | >5% |
| Epirubicyna | >900 mg/m2 | Dysfunkcja lewej komory | >5% |
| Paclitaksel | 950-1000 mg/m2 | Dysfunkcja lewej komory | 1-5% |
| Paklitaksel | 950-1000 mg/m2 | Niedokrwienie mięśnia serca | <1% |
| Paklitaksel | 950-1000 mg/m2 | Wydłużenie QTc | <1% |
| Docetaksel | 400-600 mg/m2 | Dysfunkcja lewej komory | 1-5% |
| Docetaksel | 400-600 mg/m2 | Niedokrwienie mięśnia serca | 1-5% |
| Cyklofosfamid | >100-120 mg/kg | Dysfunkcja lewej komory | 1-5% |
| Kapecytabina | 280-300 g/m2 | Niedokrwienie mięśnia serca | 1-5% |
| 5-Fluorouracyl | 3-4 g/m2 | Niedokrwienie mięśnia serca | 1-5% |
Ze względu na konieczność unikania kardiotoksyczności coraz częściej wprowadza się do leczenia wzesnego raka piersi schematy leczenia nie zawierające antracyklin lub z niższą kumulacyjną dawka antarcyklin (schematy sekwencyjne).
Wiele terapii celowanych, zwłaszcza przeciwciała monoklonalne i inhibitory kinazy tyrozynowej (TKI), zakłócają szlaki molekularne kluczowe dla zdrowia układu sercowo-naczyniowego [12,13,21]. Częstość występowania dysfunkcji lewej komory w trakcie stosowania leków celowanych molekularnie przedstawiono w tabeli 2.
Tabela 2. Częstość występowania dysfunkcji lewej komory związanej z lekami celowanymi molekularnie wykorzystywanymi w terapii przeciwnowotworowej [5].
| Lek celowany molekularnie | Częstość występowania dysfunkcji lewej komory % |
| Trastuzumab (bez antracyklin) | 1.7-5.1 |
| Trastuzumab u pacjentów otrzymujących jednocześnie antracykliny | 20.1 |
| Bewacyzumab | 1.6 – 4 |
| Lapatynib | 0.2 – 1.5 |
| Ewerolimus | <1 |
Najlepiej zbadana i opisana jest kardiotoksyczność wynikająca z zastosowania trastuzumabu. Trastuzumab to rekombinowane, humanizowane przeciwciało monoklonalne IgG1. Łączy się ono wybiórczo z receptorem ludzkiego naskórkowego czynnika wzrostu 2 (ang. human epidermal growth factor receptor 2 – HER2), hamując proliferację komórek, które wykazują zwiększoną ekspresję receptora HER2. Ponadto trastuzumab jest silnym mediatorem cytotoksyczności komórkowej zależnej od przeciwciał (antibody-dependent cellular cytotoxicity – ADCC). Pobudza cytotoksyczność typu ADCC wobec komórek nowotworu wykazujących zwiększoną ekspresję receptora HER2 [22].
Wykazano, że szczególnie kardiotoksyczne jest jednoczasowe stosowania trastuzumabu i antracyklin, dlatego nie jest ono obecnie rekomendowane, nawet przy niskich dawkach kumulacyjnych doksorubicyny (<300 mg/m2) [23].
Badania prowadzone w leczeniu uzupełniającym wczesnego raka piersi wykazały, że częstość zgonów z przyczyn sercowych i ciężkiej zastoinowej niewydolności serca nie różniła się istotnie między pacjentami leczonymi trastuzumabem a tymi, którzy nie otrzymywali tego leku ( różnica <4%). Jednak duża liczba pacjentów przerywała leczenie trastuzumabem z powodu bezobjawowego pogorszenia czynności serca [24,25]. Na uwagę zasługuje badanie FinHer , w którym trastuzumab podawano przez 9 tygodni w połączeniu z taksanem przed chemioterapią z antracyklinami (FEC) nie stwierdzając żadnych powikłań kardiologicznych w grupie chorych otrzymujących trastuzumab, a następnie antracykliny. Wytłumaczeniem tej obserwacji może być hipoteza, że zastosowanie trastuzumabu przed antracyklinami mogło pozwolić kardiomiocytom na regenerację przed chemioterapią [26,27].
Obecnie trwają badania nad identyfikacją biomarkerów, które można zastosować do wczesnego wykrywania kardiotoksyczności wywołanej przez trastuzumab, między innymi troponiną I (TnI) i peptydem natriuretycznym (proBNP) [5].
Trzeba podkreślić, że stosowanie trastuzumabu po antracyklinach lub w schematach leczenia w ogóle nie zawierających antracyklin radykalnie zmniejszyło ryzyko objawów uszkodzenia serca. Z drugiej strony wykazano, że długotrwała ekspozycja na antracykliny może powodować zwiększoną ekspresję receptora HER2 na kardiomiocytach [28,29] i zwiększone ryzyko uszkodzenia serca w trakcie terapii antyHER2.
Z cała pewnością nie wykazano różnic w kardiotoksyczności pomiędzy różnymi schematami podawania trastuzumabu (co tydzień lub co 3 tygodnie) ani też, pomiędzy formą dożylna a podskórną tego leku [25,30].
W wielu publikacjach podkreśla się fakt, że kardiotoksyczność trastuzumabu nie jest związana z jego dawka kumulacyjną. Jednak wykazano bezsprzecznie, że wystąpienie powikłań kardiotoksycznych jest związane z długością ekspozycji na trastuzumab, im dłuższy czas ekspozycji, tym większe ryzyko wystąpienia powikłań kardiotoksycznych [25,31].
Problem kardiotoksyczności indukowanej pertuzumabem oceniano w kilku badaniach klinicznych. W neoadjuwantowym badaniu klinicznym NeoSphere nie zaobserwowano znaczącego wzrostu przypadków wystąpienia dysfunkcji lewej komory wraz z dodaniem pertuzumabu do trastuzumabu [32] .
Ciekawe są też wyniki pracy opublikowanej przez Lenihana i współpracowników, gdzie przedstawiono wyniki analizy przeprowadzonej na dużej bazie danych, 598 pacjentów leczonych pertuzumabem w celu oceny częstości występowania bezobjawowej dysfunkcji LVEF i objawów niewydolności serca. U W grupie leczonej podwójna blokadą antyHER2 u 6 pacjentów (6,5%) wystąpiła bezobjawowa dysfunkcja LVEF, a u 1 pacjenta (1,1%) wystąpiła objawowa niewydolność serca [33].
Wydaje się więc, że dodanie pertuzumabu do terapii zawierającej trastuzuamab nie zwiększa zupełnie ryzyka wystąpienia powikłań kardiotoksycznych, co próbuje się tłumaczyć brakiem wpływu pertuzumabu na dimeryzację receptorów HER kardiomiocytów [34].
W badaniu klinicznym III fazy KATHERINA, oceniającym leczenie uzupełniające chorych, których nie osiągnięto całkowitej remisji patologicznej po terapii neoadjuwantowej, co prawda częściej obserwowano zdarzenia niepożądane w ramieniu z TDM-1 (98.8% vs 93.3%), ale toksyczności sercowo- naczyniowe w tej grupie były rzadkie: u 2.0% chorych zaobserwowano nadciśnienie tętnicze w stopniu 3 lub 4, a u 1.2% spadła wartość frakcji wyrzutowej lewek komory. Poważne objawy kardiotoksyczne opisano u 4 pacjentów w grupie trastuzumabu (0,6%) i 1 pacjenta w grupie T-DM1 (0,1%) [35].
Nieznaczne ryzyko kardiotosyczności związane jest z podawaniem wewnątrzkomórkowych inhibitorów kinazy tyrozynowej. W opublikowanej w 2017 metaanalizie oceniono 26 badań klinicznych (prawie 5500 pacjentów) pod kątem sercowo-naczyniowych zdarzeń niepożądanych indukowanych laptynibem. Stwierdzono, że wszystkie zdarzenia sercowo-naczyniowe (zaburzenia rytmu serca, spadek LVEF i inne) dotyczyły tylko 3.00% leczonych, a częstość występowania dysfunkcji lewej komory i spadek LVEF wystąpił tylko u 1.70% chorych [36]. Neratynib z kolei na podstawie obecnie dostępnych publikacji uważany jest za lek pozbawiony ujemnego wpływu na układ sercowo-naczyniowy [37].
Podczas stosowania niektórych terapii onkologicznych mogą pojawiać się zaburzenia rytmu serca. Najczęstszą przyczyną ich występowania jest wydłużenie odstępu QT. Trzeba pamiętać, że wydłużeniu odstępu QT sprzyjają zaburzenia elektrolitowe oraz jednoczesne stosowanie innych preparatów, takich jak tamoksyfen, leki przeciwwymiotne, psychotropowe, niektóre antybiotyki, niektóre leki kardiologiczne, rywaroksabam [20]. Wydłużenie QT może prowadzić do zagrażających życiu zaburzeń rytmu, takich jak torsade de pointes czy też inne komorowe zaburzenia rytmu [5].
Najczęściej wydłużenie odstępu QT obserwuje się w trakcie stosowania leków z grupy inhibitorów kinazy tyrozynowej oraz jednego z inhibitorów kinaz cyklininozależnych (CDK4/6) – rybocyclibu [38].
W przypadku rybocyclibu wydłużenie odstępu QT dotyczyło około 3.3% pacjentów, przy czym nieco częściej dotyczyło chorych stosujących jednocześnie tamoksyfen [39].
Zgodnie z obecnie obowiązującymi wytycznymi bardzo ważne jest, aby przed kwalifikacją do potencjalnie kardiotoksycznych terapii przeprowadzić dokładna ocenę podmiotową w celu ustalenia indywidualnych czynników ryzyka występujących u określonego chorego. Należą do nich choroby współistniejące takie jak: otyłość, siedzący tryb życia, palenie papierosów, cukrzyca, nadciśnienie tętnicze, choroba wieńcowa, zaburzenia rytmu serca, inne choroby serca, choroby tarczycy, wcześniejsze leczenie onkologiczne, w tym radioterapia, rodzaj nowotworu, przyjmowane leki [5].
W przypadku leków, które mogą potencjalnie wywołać dysfunkcję mięśnia serca oraz niewydolność serca wskazane jest wykonanie echokardiografii, o ile to możliwe z oceną GLS.
Zawsze w przypadku, gdy planujemy włączenie leków mogących wydłużać odstęp QT należy wykonać EKG i ocenić wyjściowe QTc [5,6].
Podczas prowadzenia leczenia konieczne jest wdrożenie postepowania monitorującego wystąpienie ewentualnych objawów sercowo-naczyniowych w zależności od stosowanej terapii i ryzyka wystąpienia poszczególnych powikłań [6].
Konieczna jest także współpraca z kardiologiem w celu ustalenia indywidualnego, optymalnego planu postepowania w przypadku pojawienia się objawów uszkodzenia układu sercowo-naczyniowego [5,6].
Piśmiennictwo:
1.Ferlay J, Steliarova-Foucher E, Lortet-Tieulent J et al. Cancer incidence and mortality patterns in Europe: estimates for 40 countries in 2012. Eur J Cancer, 2013; 49: 1374–1403.
2.Siegel R, DeSantis C, Virgo K et al. Cancer treatment and survivorship statistics, 2012. CA Cancer J Clin, 2012; 62: 220–241.
3.Ewer MS, Ewer SM. Cardiotoxicity of anticancer treatments. Nat Rev Cardiol, 2015; 12: 620.
4. Armstrong GT, Oeffinger KC, Chen Y et al. Modifiable risk factors and major cardiac events among adult survivors of childhood cancer. J Clin Oncol, 2013; 31: 3673–3680.
5. Zamorano JL, Lancelotti P, Rodriguez Muñoz D et al. Stanowisko ESC dotyczące toksycznego wpływu leczenia onkologicznego na układ sercowo-naczyniowy w 2016 roku, opracowane pod auspicjami Komisji ESC do spraw Wytycznych Postępowania. Kardiol Pol, 2016; 74: 1193–1233. doi: 10.5603/KP.2016.0156.
6. Bowles EJ, Wellman R, Feigelson HS, et al.Risk of heart failure in breast cancer patients after anthracycline and trastuzumab treatment: a retrospective cohort study. J Natl Cancer Inst. 2012;104:1293-1305.
7. Aleman BM, Moser EC, Nuver J, et al. Cardiovascular disease after cancer therapy. EJC Suppl. 2014;12:18-28.
8. Swain SM, Whaley FS, Ewer MS. Congestive heart failure in patients treated with doxorubicin: a retrospective analysis of three trials. Cancer, 2003; 97: 2869–2879.
9. Doroshow JH. Anthracycline antibiotic-stimulated superoxide, hydrogen peroxide, and hydroxyl radical production by NADH dehydrogenase. Cancer Res, 1983; 43: 4543–4551.
10. Barry E, Alvarez JA, Scully RE, et al. Anthracycline-induced cardiotoxicity: course, pathophysiology, prevention and management. Expert Opin Pharmacother. 2007; (8): 1039-58.
11. Curigliano T, Cardinale D, Suter T, et al. Cardiovascular toxicity induced by chemotherapy, targeted agents and radiotherapy: ESMO Clinical Practice Guidelines Ann of Oncol, 2012; 23 (7): 155–166.
12. Ewer, S.M., Ewer, M.S., 2008. Cardiotoxicity profile of trastuzumab. Drug Saf. 31 (6),459–467
13. Leemasawat K, Phrommintikul A, Chattipakorn SC, Chattipakorn N Mechanisms and potential interventions associated with the cardiotoxicity of ErbB2‑targeted drugs: Insights from in vitro, in vivo, and clinical studies in breast cancer patients. Cellular and Molecular Life Sciences https://doi.org/10.1007/s00018-019-03340-w
14. Wouters KA, Kremer LCM, Miller TL, Herman EH, Lipshultz SE. Protecting against anthracycline-induced myocardial damage: a review of the most promising strategies. Br J Haematol. 2005;131:561- 578.
15. Martin M, Pienkowski T, Mackey J, et al. Adjuvant docetaxel for node-positive
breast cancer. N Engl J Med. 2005;352:2302-2313.
16. Barrett-Lee PJ, Dixon JM, Farrell C, et al. Expert opinion on the use of anthracyclines
in patients with advanced breast cancer at cardiac risk. Ann Oncol. 2009; 20:816-827.
17. Swain SM, Whaley FS, Ewer MS. Congestive heart failure in patients treated with doxorubicin: a retrospective analysis of three trials. Cancer. 2003;97:2869-2879.
18. Curigliano G, Cardinale D, Dent S, et al. Cardiotoxicity of anticancer treatments: Epidemiology, detection, and management. CA Cancer J Clin. 2016;66(4):309-325. doi:10.3322/caac.21341
19. Crozier JA, Swaika A, Moreno-Aspitia A. Adjuvant chemotherapy in breast cancer: to use or not to use, the anthracyclines. World J Clin Oncol. 2014;5:529-538.
20. Yeh ET, Bickford CL. Cardiovascular complications cancer therapy: incidence, pathogenesis, diagnosis, and management. J Am Coll Cardiol. 2009;53:2231-2247.
21. Force T, Kolaja KL. Cardiotoxicity of kinase inhibitors: the prediction and translation of preclinical models to clinical outcomes. Nat Rev Drug Discov. 2011;10:111-126.
22. Slamon DJ, Leyland-Jones B, Shak S, Fuchs H et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med 344:783–792, 2001
23. Seidman, A., Hudis, C., Pierri, M.K., et al., 2002. Cardiac dysfunction in the trastuzumab clinical trials experience. J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol.20 (5), 1215–1221
24. Telli, M.L., Witteles, R.M., Trastuzumab-related cardiac dysfunction. J. Natl. Compr. Canc. Netw.: JNCCN 9 (2), 243–249. 2011.
25. Telli, M.L., Hunt, S.A., Carlson, R.W., Guardino, A.E., 2007. Trastuzumab-related cardiotoxicity: calling into question the concept of reversibility. J. Clin. Oncol.25 (23), 3525–3533.
26. Joensuu, H., Kellokumpu-Lentinen, P., Bono, P., Adjuvant docetaxel or vinorelbine with or without trastuzumab for breast cancer. N. Eng. J. Med. 354(8), 809–820.2006
27. Bird, B.R., Swain, S.M., Cardiac toxicity in breast cancer survivors: review of potential cardiac problems. Clin. Cancer Res. 14 (1), 14–24.2008
28. Horie T, Ono K, Nishi H et al. Acute doxorubicin cardiotoxicity is associated with miR-146a-induced inhibition of the neuregulin- ErbB pathway. Cardiovasc Res 87:656–664. 2010
29. Gabrielson K, Bedja D, Pin S. et al. Heat shock protein 90 and ErbB2 in the cardiac response to doxorubicin injury. Cancer Res 67:1436–1441. 2007
30. Quartino AL, Hillenbach C, Li J et al. Population pharmacokinetic and exposure-response analysis for trastuzumab administered using a subcutaneous “manual syringe” injection or intravenously in women with HER2-positive early breast cancer. Cancer Chemother Pharmacol 77:77–88. 2016
31. Earl HM, Vallier AL, Dunn J, et al. Trastuzumab- associated cardiac events in the Persephone trial. Br JCancer 115:1462–1470.2016
32. Gianni, L., Pienkowski, T., Im, Y.H. et al. Efficacy and safety of neoadjuvant pertuzumaband trastuzumab in women with locally advanced, inflammatory, or earlyHER2-positive breast cancer (NeoSphere): a randomized multicentre,open-label, phase 2 trial. Lancet Oncol. 13, 25–32. 2012
33. Lenihan, D., Suter, T.M., Brammer, M. et al.Pooled anaylsis of cardiac safety in patients with cancer treated with pertuzumab. Ann. Oncol. 23, 791–800.2012
34. Franklin MC, Carey KD, Vajdos FF. et al. Insights into ErbB signaling from the structure of the ErbB2-pertuzumab complex. Cancer Cell 5:317–328.2004
35. von Minckwitz G, Huang C-S, Mano MS,et al. Trastuzumab Emtansine for Residual Invasive HER2-Positive Breast Cancer. N Engl J Med 2019; 380:617-628. 2019.
36. Choi HD, Chang MJ Cardiac toxicities of lapatinib in patients with breast cancer and other HER2-positive cancers: a meta-analysis. Breast Cancer Res Treat (2017.) 166:927–936. 2017
37. Nerlynx (neratinib) [package insert] (2017). Puma Biotechnology, Los Angeles, CA
38. Kisqali, Charakterystyka produktu leczniczego, https://www.ema.europa.eu/en/documents/product-information/kisqali-epar-product-information_pl.pdf
39. Alomar M, Fradley MG Electrophysiology Translational Considerations in Cardio-Oncology: QT and Beyond. Journal of Cardiovascular Translational Research https://doi.org/10.1007/s12265-019-09924-y
Autorka: dr n med. Agnieszka Jagiełło-Gruszfeld, jest onkologiem klinicznym, pracuje w Klinice Nowotworów Piersi i Chirurgii Rekonstrukcyjnej w Narodowym Instytucie Onkologii im. Marii Skłodowskiej-Curie w Warszawie. Państwowy Instytut Badawczy. Zawodowo koncentruje się na leczeniu chorych na raka piersi. Szczególnie interesuje się onkologią geriatryczną. Od ponad 10 lat jest członkiem SIOG (International Society of Geriatric Oncology), obecnie reprezentantem Polski w tej organizacji. Jest także członkiem PTO, PTOK, ESMO, ASCO.


